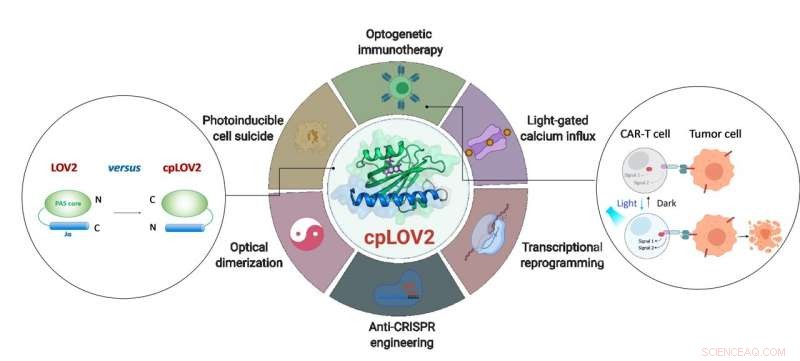
La conception de cpLOV2 et son application étendue en génie optogénétique. Crédit :ZHU Lei
Récemment, Le professeur WANG Junfeng du High Magnetic Field Laboratory des Hefei Institutes of Physical Science (HFIPS), avec des universitaires internationaux, développé un roman lumière-oxygène-tension 2 (LOV2) permuté circulaire pour élargir le répertoire de photocommutateurs génétiquement codés, qui accélérera la conception de nouveaux dispositifs optogénétiques. Le résultat a été publié dans Nature Chimie Biologie .
Le domaine LOV2 est un photocommutateur sensible à la lumière bleue. Dans un dispositif optogénétique typique basé sur LOV2, un domaine effecteur est fusionné après l'hélice Jα C-terminale de LOV2, l'intention de mettre en cage l'effecteur via un encombrement stérique dans l'obscurité. En photostimulation, le dépliement déclenché par la lumière de l'hélice Jα expose le domaine effecteur pour restaurer sa fonction. La fabrication d'une protéine photocommutable basée sur LOV2 nécessite souvent d'énormes efforts d'ingénierie pour optimiser chaque composant et le lieur de connexion entre les deux. Par conséquent, il est souhaitable d'élargir la boîte à outils optogénétique actuelle en créant de nouveaux modules qui simplifient ces étapes.
Dans cette étude, les chercheurs ont conçu cpLOV2 en utilisant la permutation circulaire, une approche robuste d'ingénierie des protéines précédemment utilisée pour développer de nouvelles variantes de sondes fluorescentes et de biocatalyseurs génétiquement codés. Les extrémités azote (N) et carbone (C) de cpLOV2 ont été créées à l'extrémité N-terminale de l'hélice Jα tandis que les anciennes étaient reliées par un lieur riche en glycine et en sérine. Par conséquent, l'effecteur pourrait être fusionné avant l'extrémité N-terminale Jα de cpLOV2 en plus de l'extrémité C-terminale dans LOV2.
En utilisant la spectroscopie RMN haute résolution et d'autres techniques, les chercheurs ont démontré que l'intégrité structurelle et la fonction de dissociation Jα induite par la lumière de cpLOV2 sont bien maintenues. cpLOV2 a également été bien travaillé dans LOVTRAP et a amélioré le dimère induit par la lumière (iLid), les deux sont des systèmes d'hétérodimérisation optique basés sur LOV2.
cpLOV2 a fourni plus de choix pour le développement d'applications optogénétiques. Les chercheurs ont généré une série d'hybrides en fusionnant LOV2 ou cpLOV2 avec différents Ca 2+ fragments d'activation de canaux et d'autoinhibition dérivés de la molécule d'interaction stromale 1, et a trouvé plusieurs nouveaux actionneurs optiques basés sur cpLOV2 pour déclencher ORAI1 Ca 2+ canaliser, par conséquent, ils ont démontré que cpLOV2 pouvait offrir de nouvelles surfaces de mise en cage pour surmonter les limitations associées à LOV2 de type sauvage.
Pour les effecteurs requis un terminus libre N pour exécuter sa fonction complète, cpLOV2 est un meilleur choix. Une protéine clé impliquée dans la nécroptose, protéine de type domaine kinase de lignée mixte (MLKL), était le succès en cage et non en cage dans cpLOV2-MLKL mais pas MLKL-LOV2 pour le contrôle optique des suicides cellulaires.
La thérapie par les cellules T du récepteur de l'antigène chimérique (CAR) est devenue une approche immunothérapeutique prometteuse. Cependant, l'activité incontrôlable des cellules CAR T pendant le traitement provoquerait des effets secondaires graves, par ex. syndrome de libération de cytokines chez certains patients. Les chercheurs ont conçu des systèmes d'hétérodimérisation optique basés sur cpLOV2 (cpLID), et un CAR divisé photo-accordable construit (optoCAR). Les cellules thérapeutiques optoCAR T peuvent être spécifiquement activées par l'antigène tumoral CD19 et la lumière bleue, puis proliférer pour tuer le CD19 + Cellules de lymphome Raji.
Dans un modèle de souris implanté avec CD19 + cellules Raji, les chercheurs ont utilisé des nanoparticules de conversion ascendante (UCNP) pour convertir la lumière proche infrarouge à haute pénétration tissulaire en lumière bleue et activer les cellules optoCAR T injectées et ont obtenu un traitement très efficace de la tumeur lymphome. Les cellules OptoCAR T développées dans cette étude permettent le contrôle spatio-temporel et réversible des activités des cellules T et de la production de cytokines.
Ces résultats encourageants suggèrent que les cellules optoCAR T pourraient atténuer les effets secondaires potentiels sans perdre en efficacité thérapeutique. À l'avenir, ils prévoient d'essayer l'immunothérapie optogénétique pour traiter différents types de cancer.