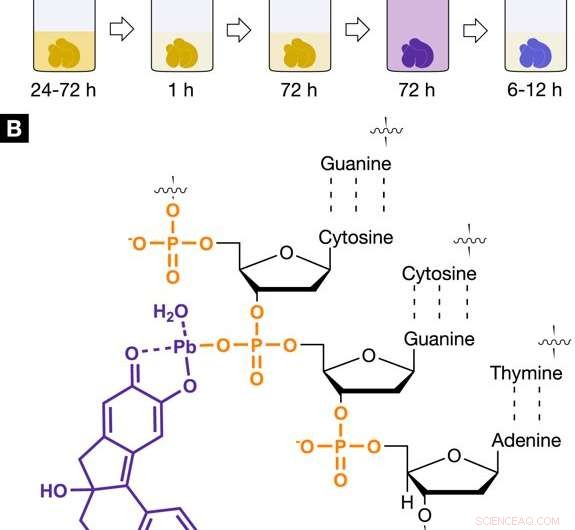
La radiographie appropriée, protocole d'agent de coloration spécifique au noyau pour l'histologie virtuelle 3D. Protocole de coloration et interaction de la coloration aux rayons X à base d'hématine avec les tissus mous. (A) La procédure de coloration à base d'hématine développée montre les étapes individuelles impliquées, y compris les temps d'incubation et de coloration. L'étape de coloration 1 a été réalisée en utilisant du trihydrate d'acétate de plomb (II) comme source de métaux lourds. L'acétate de plomb (II) trihydraté a été dissous dans de l'eau distillée et est appelé solution de travail (A) (WS (A)). L'étape de coloration 2 impliquait une solution d'hématéine dans de l'éthanol absolu (WS (B), 10 % (p/v) ; c = 333 mM), qui était dérivé de l'hématoxyline et a été ajouté à WS (A). (B) Le complexe plomb (II) d'hématéine chargé positivement (violet), qui est construit in situ dans l'échantillon de tissus mous, interagit avec le squelette phosphate chargé négativement de l'ADN (orange) présent dans le noyau de la cellule. L'interaction sélective du complexe hématéine plomb (II) avec l'ADN est obtenue par acidification des tissus mous pendant la fixation ou avant la coloration et permet une accumulation plus élevée du complexe hématéine plomb (II) dans le noyau cellulaire. Crédit: Rapports scientifiques , doi :https://doi.org/10.1038/s41598-018-36067-y
L'histologie est utilisée pour identifier les détails structurels des tissus à l'échelle microscopique dans le laboratoire de pathologie, mais les analyses restent bidimensionnelles (2D) car limitées au même plan. Les technologies 3D non destructives, y compris la micro et nano tomographie par rayons X (nanoCT), ont fait leurs preuves pour comprendre les structures anatomiques, car ils permettent des angles de vision arbitraires et des détails structurels 3D. Cependant, la faible atténuation des tissus mous a entravé leur application dans le domaine de l'histologie virtuelle 3D. Dans une étude récente, maintenant publié le Rapports scientifiques , Mark Müller et ses collègues du Département de physique et de bio-ingénierie ont développé une méthode de coloration aux rayons X à base d'hématine pour cibler spécifiquement les noyaux cellulaires, suivi de démonstrations sur un lobule hépatique entier de souris.
Le nouveau protocole de coloration combinait le récemment développé, système nanoCT haute résolution pour la visualisation 3D de l'architecture tissulaire à l'échelle nanométrique. Les résultats ont révélé la morphologie 3D réelle ainsi que la distribution spatiale des noyaux cellulaires. La technique était également compatible avec l'histologie conventionnelle, car les lames microscopiques avec un échantillon de tissus mous pourraient être colorées avec le même protocole avec une contre-coloration supplémentaire. La méthode a démontré la possibilité d'applications futures en histopathologie accompagnées d'appareils de tomodensitométrie à rayons X en laboratoire.
L'histologie est l'étalon-or existant pour un diagnostic microanatomique précis dans le laboratoire de pathologie, cependant, les techniques et les résultats sont limités à la 2D. Par exemple, une biopsie 3D est généralement examinée à l'aide de lames microscopiques très minces (contenant des tranches de 2 à 10 µm d'épaisseur) via des techniques de coloration immunohistochimiques et histologiques conventionnelles et modernes. Les micro et nano-CT sont des outils puissants qui peuvent fournir une reconstruction précise des tissus en 3D. Les développements de la technologie ont permis une résolution comparativement élevée à l'histologie conventionnelle 2D existante, en utilisant des appareils allant des grands accélérateurs de particules aux appareils à rayons X en laboratoire.
Outre les exigences techniques, agents de coloration adaptés aux rayons X (agents de contraste) tels que l'acide phototungstique (PTA), l'iodure de potassium et d'iode (IKI), l'iode dans l'éthanol (12E), ou l'iode dans le méthanol (12M) sont également importants. Les agents de coloration disponibles sont cependant, actuellement limité en portée et en efficacité. Lors du développement de diagnostics médicaux de nouvelle génération en histopathologie, les scientifiques visent à optimiser les techniques et à comprendre l'architecture tissulaire du niveau cellulaire à l'échelle tissulaire.
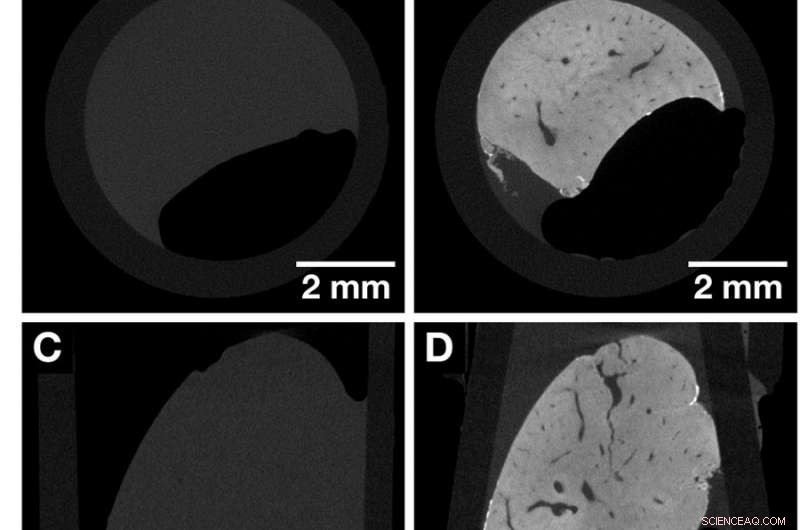
Coupes CT du même lobule hépatique entier de souris avant et après coloration mettant en évidence le rehaussement de contraste obtenu après application de la coloration aux rayons X à base d'hématine. Les deux ensembles de données ont été acquis avec le Xradia Versa 500 microCT en utilisant des paramètres d'acquisition identiques. La taille des voxels dans les deux ensembles de données est de 13,5 µm. (UNE, C et E) Vue d'ensemble des images du lobule hépatique de souris non coloré représentant les vues le long des axes cartésiens. (B, D et F) Aperçu des images du même échantillon de lobule hépatique de souris dans (A, C et E) après coloration représentant les vues selon les axes cartésiens. Les structures anatomiques telles que le système vasculaire sont visualisées. Crédit: Rapports scientifiques , doi :https://doi.org/10.1038/s41598-018-36067-y.
Lors du premier diagnostic en pathologie clinique, les noyaux cellulaires et le cytoplasme sont importants. Presque tous les échantillons histologiques sont donc souvent colorés via le protocole standard d'hématoxyline et d'éosine (H&E) pour identifier les noyaux et le cytoplasme. Mais les normes pour la coloration à l'hématoxyline ne sont pas fixes et de nombreuses variantes du protocole existent en raison de divers types de tissus et/ou paramètres de pré-traitement impliqués. Par conséquent, Muller et al. introduit un protocole de coloration à base d'hématine, spécifiquement développé pour le CT, pour permettre la visualisation 3D directe des noyaux cellulaires dans des échantillons de tissus mous. Le puissant potentiel de la microCT ou de la nanoCT combiné à des colorations adaptées aux rayons X permettra de futures connaissances sur l'organisation des tissus pour comprendre les maladies, y compris l'arthrose et le cancer, à la nanoarchitecture cellulaire.
Lors du développement de la nouvelle radiographie appropriée, colorant à base d'hématine, l'hématoxyline de Mayer couramment utilisée et l'hématoxyline de fer de Wiegert ont été incluses dans sa constitution. Les expériences de coloration ont été menées sur le tissu du lobule hépatique de souris, utilisé pour l'imagerie par rayons X par la suite. Le protocole de coloration optimisé contenait cinq étapes commençant par une acidification contrôlée des échantillons de tissus mous pendant la fixation. Les tissus mous ont été préparés au niveau moléculaire pour être colorés avec le complexe hématéine plomb (II).
Dans son mécanisme d'action, les scientifiques ont montré une interaction ionique renforcée entre le complexe plomb hématéine (II) chargé positivement et le squelette phosphate chargé négativement de l'acide désoxyribonucléique (ADN). La réaction chimique a assuré une accumulation plus élevée de l'agent de coloration dans les noyaux cellulaires en formant un complexe d'ADN de plomb (II) d'hématine, comme agent approprié aux rayons X.

Données NanoCT (A–C) en comparaison avec la lame microscopique histologique (D) dérivée du même lobule hépatique de souris après application du protocole de coloration aux rayons X à base d'hématine. Une visualisation claire des noyaux cellulaires des hépatocytes plus gros et des noyaux cellulaires plus petits tels que les cellules de Kupffer et les SEC en blanc (A-C) ou violet foncé (D) et le réseau BC affiché en noir (A-C) ou en blanc (D) a été obtenu, respectivement. (A) Le volume d'intérêt (VOI) mettant en évidence les deux tranches de nanoCT montrées dans (B, cadre bleu) et (C, cadre orange). (B, C) Tranches de nanoCT individuelles représentatives comme indiqué dans le VOI de (A). (B) et (C) sont positionnés orthogonaux l'un à l'autre. L'orientation du réseau BC, qui est formé par les hépatocytes est vu, c'est-à-dire qu'une disposition plus horizontale est vue en (B) et un alignement plus vertical en (C). L'épaisseur de la tranche nanoCT est de 580 nm. (D) Lame microscopique histologique représentative d'une épaisseur de 3 µm obtenue à partir du même échantillon de lobule hépatique de souris après avoir appliqué le colorant à base d'hématine et l'avoir intégré dans un bloc de paraffine. Crédit: Rapports scientifiques , doi :https://doi.org/10.1038/s41598-018-36067-y.
Pour comparer l'efficacité de la coloration, le tissu du lobule hépatique de souris a été imagé par microCT avant coloration, suivi d'une imagerie après coloration basée sur le protocole d'hématine. Le processus de coloration s'est déroulé en deux étapes et l'amélioration du contraste souhaitée a été obtenue comme prévu après la coloration. Les résultats ont été observés à l'aide de la vue d'ensemble microCT pour montrer des structures anatomiques distinctes, y compris le système vasculaire. La coloration était homogène dans tout le lobule hépatique de la souris, contrairement aux exemples précédents dans de grands échantillons de tissu hépatique. Le processus d'imagerie 3D a permis d'accéder à une série de coupes CT dans des plans arbitraires. Par ailleurs, contrairement à l'histologie 2D conventionnelle (avec des tissus mous inclus en paraffine), les tissus mous pouvaient être vus sous différents angles.
Le tissu a ensuite été étudié au niveau subcellulaire avec des morceaux plus petits du même lobule hépatique, qui ont été disséqués et analysés à l'aide de nanoCT. Les résultats visualisés ont montré des régions du volume d'intérêt (VOI), noyaux cellulaires des hépatocytes et noyaux d'autres types cellulaires (cellules de Kupffer et cellules endothéliales sinusoïdales). Les structures entières noires représentaient le réseau canaliculaire biliaire (BC) tandis que les valeurs grises plus foncées indiquaient le cytoplasme de l'échantillon de tissu hépatique. L'orientation du réseau BC a également été observée. Le tissu a ensuite été étudié avec une histologie conventionnelle, en utilisant des lames microscopiques très fines sans autre coloration que la coloration à base d'hématine appliquée. La technique conventionnelle a également confirmé la morphologie des hépatocytes et d'autres types cellulaires (noyaux colorés en violet foncé), tandis que le réseau BC était taché de blanc.
Noyaux 3D et analyse des différents noyaux cellulaires présents dans le volume hépatique d'intérêt (VOI) de la souris. Crédit: Rapports scientifiques , doi :https://doi.org/10.1038/s41598-018-36067-y.
Les scientifiques ont comparativement confirmé la précision de la reconstruction des données 3D dans l'étude avec des enquêtes précédentes. Lorsque la procédure à base d'hématine a été réappliquée dans les examens d'histologie 2D conventionnels, les scientifiques ont également appliqué une contre-coloration standard, spécifique à l'éosine Y, au cytoplasme cellulaire sur le tissu. Dans les résultats, les noyaux cellulaires restaient violets tandis que le cytoplasme prenait la coloration rose. De cette façon, les scientifiques ont également authentifié la capacité de coloration à base d'hématine spécifique des noyaux avec une histologie standard.
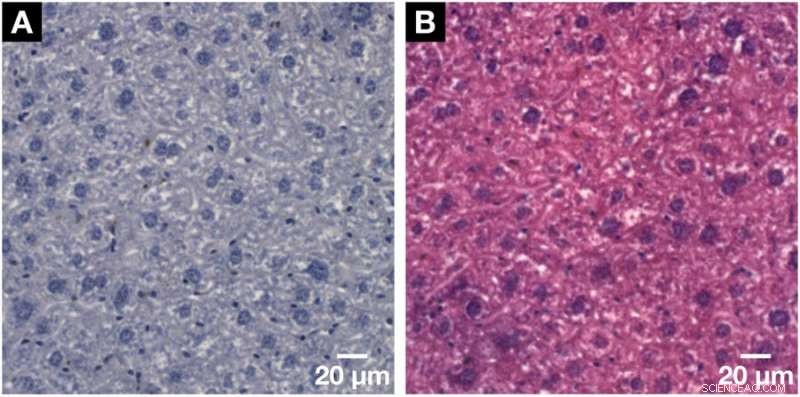
Démonstration de la compatibilité histologique de la méthode de coloration à base d'hématine développée par microCT et nanoCT pour les rayons X avec l'histologie 2D conventionnelle. (A) Lame microscopique histologique représentative d'une épaisseur de 3 µm obtenue à partir du même échantillon de lobule hépatique de souris après la coloration à base d'hématine appliquée et l'inclusion dans un bloc de paraffine. Visualisation claire des noyaux cellulaires des hépatocytes plus gros et des noyaux cellulaires plus petits tels que les cellules de Kupffer et les SEC en violet foncé et le réseau BC affiché en blanc. (B) La compatibilité avec le contre-colorant standard de l'éosine Y a été montrée sur une lame microscopique ultérieure vue en (A). Les noyaux cellulaires sont représentés en violet à côté du cytoplasme en rose, ce qui donne une lame microscopique colorée H&E typique d'un échantillon de tissus mous. Crédit: Rapports scientifiques , doi :https://doi.org/10.1038/s41598-018-36067-y.
Le protocole de coloration à base d'hématine a facilité la visualisation CT haute résolution des noyaux cellulaires dans les tissus mous dans la plage submicronique, jusqu'à présent impossible avec d'autres méthodes de coloration combinées à la technologie microCT. Les futures études histopathologiques pourraient éliminer les procédures de préparation fastidieuses et la perte d'échantillons de tissus (comme on le voit avec l'histologie standard) pour obtenir des tranches de tissus individuelles via une enquête 3D d'un VOI entier, comme démontré dans la présente étude. La capacité de dépister un échantillon plus important à la recherche de noyaux cellulaires anormaux pourrait aider les pathologistes à identifier les régions d'inflammation afin d'évaluer l'étiologie et la progression de la maladie.
Le protocole de coloration est simple et reproductible, adapté à la coloration CT d'organes entiers, couplé à la visualisation 3D et en profondeur, analyse non destructive d'échantillons de tissus mous. Les agents de coloration listés dans le protocole sont facilement accessibles, tandis que le protocole adapté aux rayons X combinés CT permet une plus grande sophistication pour les analyses d'échantillons de tissus mous. Les étapes du protocole de coloration nécessiteront une optimisation supplémentaire avec différents types de tissus et dans diverses applications, dont l'histologie 3D, études de biologie du développement et de la structure en laboratoire.
© 2018 Réseau Science X