
L'étoffe de la vie. Crédit :Shutterstock
Le phosphore est un élément essentiel qui est contenu dans de nombreux composés cellulaires, tels que l'ADN et le vecteur d'énergie ATP. Toute vie a besoin de phosphore et les rendements agricoles sont améliorés lorsque du phosphore est ajouté aux plantes en croissance et à l'alimentation du bétail. Par conséquent, il est utilisé dans le monde entier comme engrais et joue un rôle important dans la satisfaction des besoins alimentaires mondiaux.
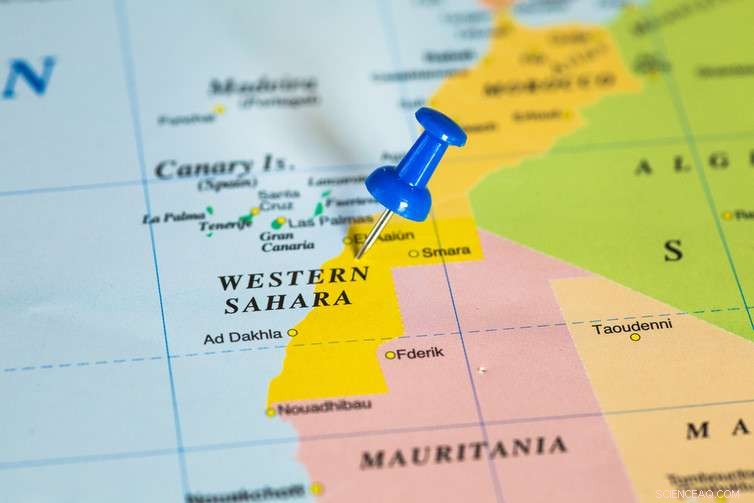
Pour que nous l'ajoutions, cependant, nous devons d'abord l'extraire d'une forme concentrée - et l'approvisionnement provient presque exclusivement des mines de phosphate au Maroc (avec des quantités beaucoup plus faibles en provenance de Chine, les Etats Unis, Jordanie et Afrique du Sud). Au Maroc, la plupart des mines sont au Sahara occidental, une ancienne colonie espagnole qui a été annexée par le Maroc en 1975.
Le fait que plus de 70 % de l'approvisionnement mondial provienne de ce seul endroit est problématique, d'autant plus que les scientifiques préviennent que nous approchons du "pic de phosphore", le point où la demande commence à dépasser l'offre et l'agriculture intensive ne peut pas continuer à fournir les rendements actuels. Dans le pire des cas, les réserves exploitables pourraient être épuisées en moins de 35 ans.
Alors, que se passe-t-il – et à quel point devrait-on s'inquiéter ?
Limites naturelles
Dans la nature, le phosphore n'existe que lié à l'oxygène, qui s'appelle phosphate. C'est sous cette forme qu'il est extrait. Les chimistes peuvent éliminer les oxygènes qui y sont liés pour obtenir du phosphore blanc élémentaire, qui brille dans le noir, mais il est si instable qu'il s'enflamme spontanément au contact de l'air.
Le phosphate diffuse facilement dans le sol ou l'eau et peut être absorbé par les cellules. Lorsque le phosphate rencontre du calcium ou du fer libre, ils se combinent pour donner des sels hautement insolubles.
Dans la première moitié du XIXe siècle, Justus von Liebig a popularisé la loi du minimum pour l'agriculture, qui affirme que la croissance est limitée par la moindre ressource disponible. On a vite découvert qu'il s'agissait souvent d'une forme de phosphore.
En conséquence, les os - composés principalement de calcium et de phosphate - provenant d'anciens champs de bataille ont été déterrés pour être utilisés dans l'agriculture. Guano, grandes accumulations de fientes d'oiseaux, contient également des concentrations élevées de phosphore et a été utilisé pour fertiliser les cultures. Mais les approvisionnements de ce ont été bientôt épuisés. Au fur et à mesure que la demande augmentait, les fournitures devaient être extraites à la place.
Voici du phosphore. Crédit :Shutterstock
Mais cet engrais phosphaté inorganique appliqué est très mobile et s'infiltre dans les cours d'eau. En outre, la roche phosphatée s'altère et est finalement emportée dans l'océan où elle se dépose sous forme de phosphate de calcium ou est absorbée par des organismes marins qui finissent également par se déposer sur le fond de l'océan lorsqu'ils meurent. Par conséquent, le phosphore terrestre ne disparaît pas vraiment, mais il peut aller au-delà de notre portée.
Gaspillage naturel
Pour compliquer encore les choses, même le phosphore que nous pouvons utiliser est en grande partie gaspillé. Du phosphore extrait comme engrais, seulement un cinquième atteint la nourriture que nous mangeons. Certains s'échappent et d'autres sont liés au calcium et au fer du sol. Certaines racines de plantes ont la capacité d'extraire ces dernières, mais pas en quantité suffisante pour tout récupérer.
En plus de ces formes inorganiques, le phosphate est également transformé en composés cellulaires, créer du phosphore organiquement lié, tels que les phospholipides ou le phytate. Après la mort d'un organisme, ces composés organiques du phosphore doivent être remis sous forme de phosphate utilisable. La quantité de phosphore organiquement lié présent dans les sols dépend du nombre et de l'activité des organismes qui peuvent le faire.
Les sols agricoles sont généralement riches en phosphore inorganique tandis que dans les écosystèmes non perturbés, comme les forêts et les pâturages à long terme, le phosphore organiquement lié domine. Mais les terres agricoles sont souvent appauvries en phosphore pendant la récolte et les pratiques de gestion des terres telles que le labour, d'où l'ajout d'engrais phosphatés.
L'épandage de fumier et l'évitement du travail du sol sont des moyens d'augmenter l'abondance microbienne dans le sol – et ainsi de conserver plus de phosphore sous une forme organiquement liée.
Les risques de pic de phosphore peuvent être contrecarrés par des solutions simples. Manger moins de viande est un début, car d'énormes quantités sont utilisées pour élever du bétail pour la viande. Il est probable que les rendements agricoles soient limités par la disponibilité du phosphore et qu'ils soient encore plus étirés à mesure que la population mondiale augmente.
Les humains eux-mêmes gaspillent du phosphore, car la plupart de ce que nous absorbons repart directement. Heureusement, des technologies ont été développées pour extraire le phosphore des eaux usées, mais à l'heure actuelle sont trop chers pour être pratiques.
Le pic de phosphore ne signifie pas que le phosphore va disparaître, plutôt que les réserves avec des concentrations élevées exploitables s'épuisent. Au lieu, nous augmentons les concentrations de fond de phosphore et l'ajoutons au fond de l'océan. Une utilisation plus durable du phosphore nécessite une meilleure appréciation et compréhension des nombreux organismes qui composent les sols - et le rôle qu'ils jouent dans la distribution du phosphore - ou nous ne pourrons peut-être plus nourrir le monde à un prix abordable.
Cet article a été initialement publié sur The Conversation. Lire l'article original. 