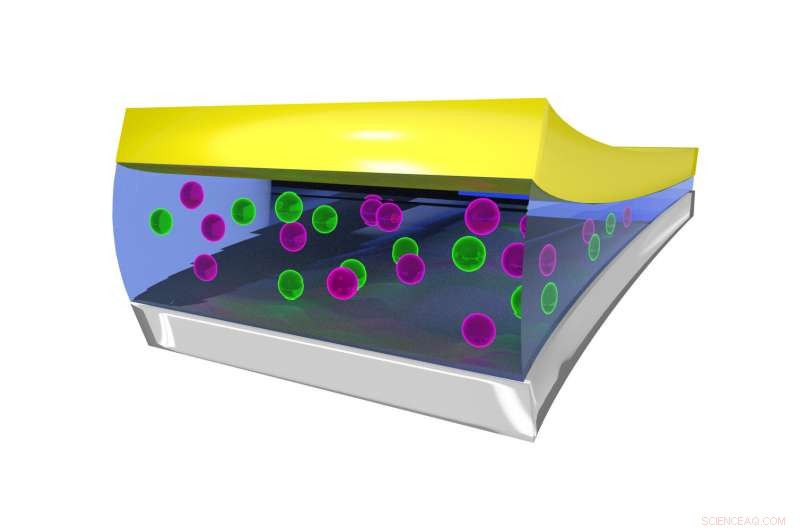
Image fixe montrant l'environnement de coordination de l'ion F dans l'électrolyte liquide, stabilisé par des molécules de BTFE. Crédit :Dr Brett Savoie – Caltech/Perdue
Imaginez ne pas avoir à recharger votre téléphone ou votre ordinateur portable pendant des semaines. C'est le rêve des chercheurs qui se penchent sur des batteries alternatives qui vont au-delà des versions lithium-ion actuelles populaires aujourd'hui. Maintenant, dans une nouvelle étude publiée dans la revue Science , chimistes dans plusieurs institutions, dont Caltech et le Jet Propulsion Laboratory, qui est géré par Caltech pour la NASA, ainsi que le Honda Research Institute et le Lawrence Berkeley National Laboratory, ont trouvé une nouvelle façon de fabriquer des batteries rechargeables à base de fluorure, la forme chargée négativement, ou anionique, de l'élément fluor.
"Les batteries au fluorure peuvent avoir une densité énergétique plus élevée, ce qui signifie qu'elles peuvent durer plus longtemps - jusqu'à huit fois plus longtemps que les batteries utilisées aujourd'hui, " déclare le co-auteur de l'étude Robert Grubbs, Victor et Elizabeth Atkins professeur de chimie de Caltech et lauréat du prix Nobel de chimie 2005. "Mais le fluorure peut être difficile à travailler, en particulier parce qu'il est si corrosif et réactif."
Dans les années 1970, les chercheurs ont tenté de créer des batteries au fluorure rechargeables en utilisant des composants solides, mais les batteries à semi-conducteurs ne fonctionnent qu'à haute température, ce qui les rend peu pratiques pour un usage quotidien. Dans la nouvelle étude, les auteurs rapportent enfin qu'ils ont trouvé comment faire fonctionner les piles au fluorure à l'aide de composants liquides et que les piles liquides fonctionnent facilement à température ambiante.
"Nous sommes encore aux premiers stades de développement, mais c'est la première batterie au fluorure rechargeable qui fonctionne à température ambiante, " dit Simon Jones, un chimiste au JPL et auteur correspondant de la nouvelle étude.
Les batteries entraînent des courants électriques en faisant circuler des atomes chargés - ou des ions - entre une électrode positive et négative. Ce processus de navette se déroule plus facilement à température ambiante lorsque des liquides sont impliqués. Dans le cas des batteries lithium-ion, le lithium est transporté entre les électrodes à l'aide d'une solution liquide, ou électrolytique.
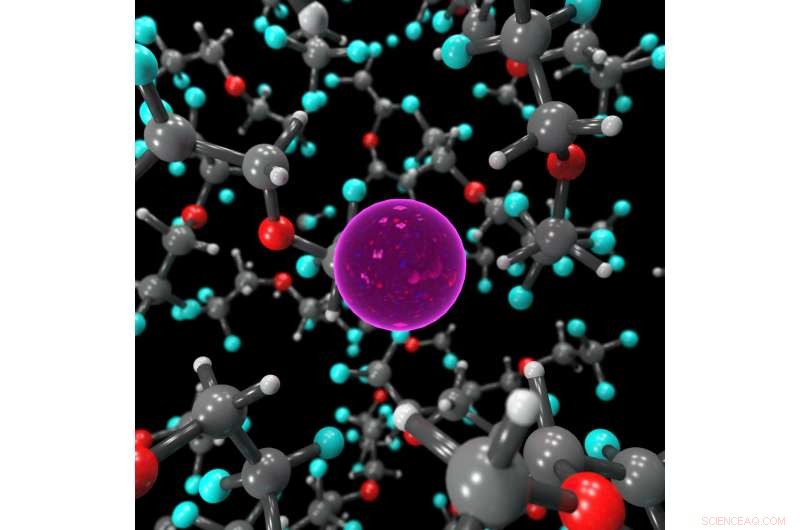
Image fixe montrant l'environnement de coordination de l'ion F dans l'électrolyte liquide, stabilisé par des molécules de BTFE. Crédit :Dr Brett Savoie – Caltech/Perdue
"Recharger une batterie, c'est comme pousser une balle en haut d'une colline puis la laisser repartir en arrière, encore et encore, " dit le co-auteur Thomas Miller, professeur de chimie à Caltech. "Vous faites des allers-retours entre le stockage de l'énergie et son utilisation."
Alors que les ions lithium sont positifs (appelés cations), les ions fluorure utilisés dans la nouvelle étude portent une charge négative (et sont appelés anions). Il y a à la fois des défis et des avantages à travailler avec des anions dans des batteries.
"Pour une batterie qui dure plus longtemps, vous devez déplacer un plus grand nombre de charges. Le déplacement de cations métalliques à charges multiples est difficile, mais un résultat similaire peut être obtenu en déplaçant plusieurs anions chargés individuellement, qui voyagent avec une relative facilité, " dit Jones, qui fait des recherches au JPL sur les sources d'énergie nécessaires aux engins spatiaux. "Les défis avec ce schéma font fonctionner le système à des tensions utilisables. Dans cette nouvelle étude, nous démontrons que les anions sont en effet dignes d'attention dans la science des batteries puisque nous montrons que le fluorure peut fonctionner à des tensions suffisamment élevées."
La clé pour faire fonctionner les batteries au fluorure à l'état liquide plutôt qu'à l'état solide s'est avérée être un électrolyte liquide appelé bis(2, 2, 2-trifluoroéthyl)éther, ou BTFE. Ce solvant est ce qui aide à maintenir l'ion fluorure stable afin qu'il puisse faire aller et venir les électrons dans la batterie. Jones dit que son stagiaire à l'époque, Victoria Davis, qui étudie maintenant à l'Université de Caroline du Nord, Colline de la Chapelle, a été le premier à penser à essayer BTFE. Alors que Jones n'avait pas beaucoup d'espoir qu'il réussisse, l'équipe a décidé de l'essayer quand même et a été surprise que cela fonctionne si bien.