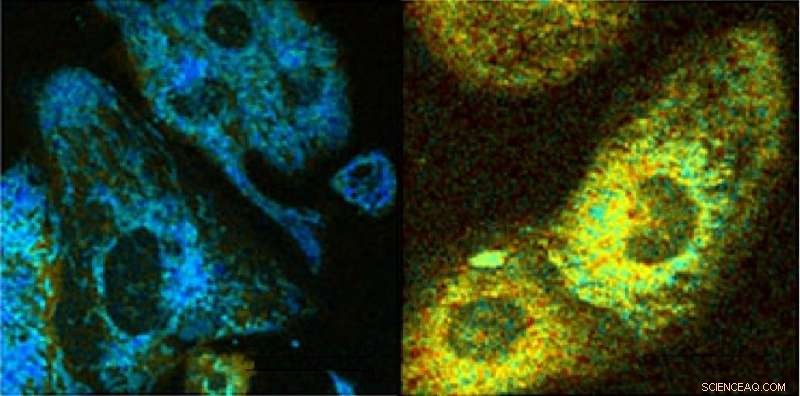
Lectures optiques des cardiomyocytes HL-1 en réponse au découplage chimique par CCCP. Carte de ratio redox pour le contrôle (à gauche), et les cardiomyocytes exposés au CCCP (à droite). Crédit :Irène Georgakoudi, Université Tufts
Des changements métaboliques dans les cellules peuvent survenir aux premiers stades de la maladie. Dans la plupart des cas, la connaissance de ces signaux est limitée, car nous ne détectons généralement la maladie qu'après qu'elle a causé des dommages importants. Maintenant, une équipe dirigée par des ingénieurs de la Tufts University School of Engineering a ouvert une fenêtre sur la cellule en développant un outil optique capable de lire le métabolisme à une résolution subcellulaire, sans avoir à perturber les cellules avec des agents de contraste, ou les détruire pour effectuer des analyses. Comme indiqué aujourd'hui dans Avancées scientifiques , les chercheurs ont pu utiliser la méthode pour identifier des signatures métaboliques spécifiques qui pourraient survenir dans le diabète, cancer, maladies cardiovasculaires et neurodégénératives.
La méthode est basée sur la fluorescence de deux coenzymes importantes (biomolécules qui fonctionnent de concert avec les enzymes) lorsqu'elles sont excitées par un faisceau laser. Les coenzymes - nicotinamide adénine dinucléotide (NADH) et flavine adénine dinucléotide (FAD) - sont impliquées dans un grand nombre de voies métaboliques dans chaque cellule. Pour connaître les voies métaboliques spécifiques affectées par la maladie ou le stress, les scientifiques de Tufts ont examiné trois paramètres :le rapport FAD/NADH, le « fondu » de fluorescence du NADH, et l'organisation des mitochondries révélée par la distribution spatiale du NADH au sein d'une cellule (les « piles » productrices d'énergie de la cellule).
Le premier paramètre - les quantités relatives de FAD par rapport au NADH - peut révéler à quel point la cellule consomme de l'oxygène, métaboliser les sucres, ou produire ou décomposer des molécules de graisse. Le deuxième paramètre, le « fondu » de fluorescence du NADH, révèle des détails sur l'environnement local du NADH. Le troisième paramètre, la distribution spatiale du NADH dans les cellules, montre comment les mitochondries se divisent et fusionnent en réponse à la croissance cellulaire et au stress.
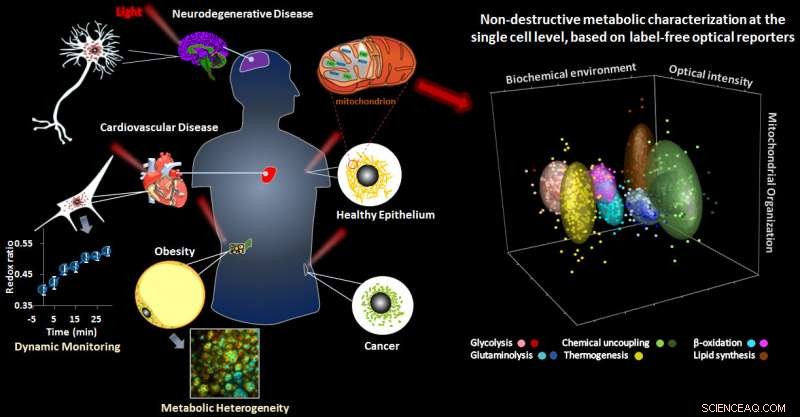
Résumé graphique de l'étude. Crédit :I. Georgakoudi, Z. Liu, et D. Pouli
"Pris ensemble, ces trois paramètres commencent à donner plus de précision, et des signatures métaboliques uniques de la santé ou du dysfonctionnement cellulaire, " a déclaré Irène Georgakoudi, Doctorat., auteur correspondant de l'étude et professeur de génie biomédical à la School of Engineering de Tufts. "La puissance de cette méthode est la capacité d'obtenir des informations sur les cellules vivantes, sans l'utilisation d'agents de contraste ou d'étiquettes attachées qui pourraient interférer avec les résultats."
D'autres méthodes existent pour suivre de manière non invasive les signatures métaboliques de la maladie, comme le PET scan, qui est souvent utilisé dans la recherche. Mais tandis que les scans TEP fournissent des informations à faible résolution avec une excellente pénétration en profondeur dans les tissus vivants, la méthode optique introduite par les chercheurs de Tufts détecte l'activité métabolique à la résolution de cellules individuelles, bien que la plupart du temps près de la surface.