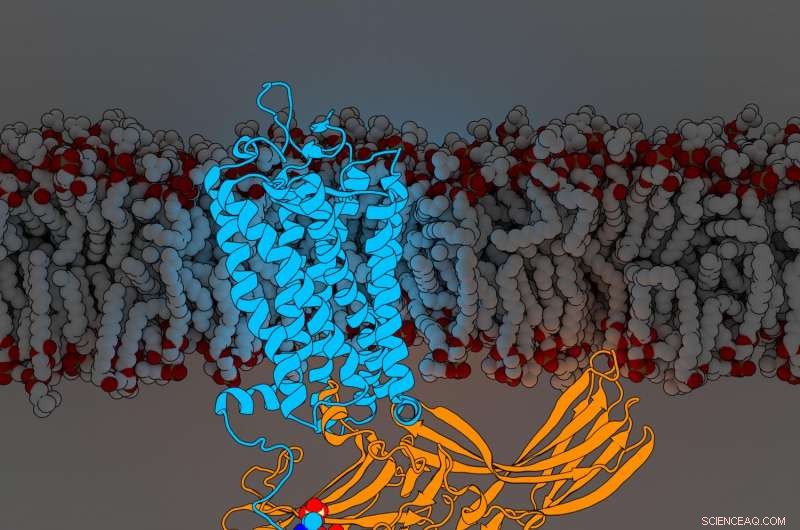
Rhodopsinarrestine. Crédit :Parker de Waal, Laboratoire Xu, Institut de recherche Van Andel
Une équipe dirigée par des scientifiques du Van Andel Research Institute a répondu à une question de longue date qui pourrait conduire à des médicaments plus efficaces avec moins d'effets secondaires pour des maladies allant de l'insuffisance cardiaque au cancer.
Les résultats, publié aujourd'hui dans Cellule , révèlent pour la première fois des composants d'un récepteur couplé aux protéines G (RCPG) nommé rhodopsine lié à une molécule de signalisation appelée arrestation, deux éléments cruciaux du réseau de communication cellulaire complexe du corps. La nouvelle découverte affine encore un point de repère 2015 La nature article qui a d'abord décrit la structure des deux molécules en complexe ensemble.
"Notre structure révisée est comme une feuille de route avec des détails supplémentaires et des caractéristiques géographiques remplies, " a déclaré le professeur VARI H. Eric Xu, Doctorat., l'auteur principal de la nouvelle étude ainsi que de l'article de 2015. "Pendant des années, le domaine a cherché à déterminer exactement comment les arrestations interagissent avec les GPCR. Nous espérons que la réponse apportée par notre travail, dans le cadre de la rhodopsine, alimentera de nouvelles recherches et la conception de meilleurs médicaments, au bénéfice ultime des patients du monde entier."
Les GPCR sont le plus grand groupe de récepteurs de surface cellulaire, et agissent comme des centres d'échange d'informations en se reliant soit à des arrestations, soit à d'autres molécules de signalisation appelées protéines G pour relayer des instructions critiques pour d'innombrables fonctions biologiques, y compris la croissance et la régulation hormonale. Ces caractéristiques, couplés à leur emplacement à la surface de la cellule, en font des cibles attractives pour la pharmacothérapie. On estime que 30% de tous les médicaments actuellement sur le marché ciblent les GPCR.
"Étant donné que les arrestations et les protéines G interviennent dans différentes réponses cellulaires, développer des médicaments qui n'activent qu'une de ces deux voies peut produire moins d'effets secondaires pour les patients, " a déclaré Karsten Melcher, Doctorat., un auteur principal sur le papier et professeur agrégé à VARI. « Les informations fournies par notre structure élargie pourraient grandement aider à orienter la conception de ces thérapies. »
Pour déterminer leur structure augmentée, Scientifique de recherche principal du Xu Lab Edward Zhou, Doctorat., réanalysé plus de 22, 000 images individuelles collectées pour l'étude originale de 2015 à l'aide d'un logiciel amélioré non disponible à l'époque. Il a révélé trois composants moléculaires précédemment cachés appelés groupes phosphoryle sur la rhodopsine et trois poches correspondantes sur l'arrestine qui agissent comme des stations d'accueil. L'arrangement spécifique de ces groupes phosphoryle - connus sous le nom de codes de phosphorylation - est nécessaire pour que la rhodopsine se lie à l'arrestine, un peu comme la combinaison d'un coffre-fort. Une fois terminé, cette interaction initie une branche d'un réseau de communication cellulaire complexe qui régule les fonctions dans tout le corps.
"La grande question est alors devenue, « Si cela se produit avec la rhodopsine et l'arrestine, cela se produit-il dans tous les GPCR ? » a déclaré Parker de Waal, un étudiant de la Van Andel Institute Graduate School et membre du laboratoire de Xu. « Nos résultats indiquent que ces codes - ces séquences spécifiques de groupes phosphoryle - se trouvent en tout ou en partie dans la plupart des RCPG. Les résultats aident à répondre avec élégance à une question de longue date dans notre domaine :pourquoi certains RCPG se lient-ils mieux que d'autres peuvent maintenant être expliqués par l'existence de codes de phosphorylation."
Il n'existait pas d'outil pour explorer la prévalence de ces codes dans les données GPCR annotées, alors de Waal en a créé un. En partie interface graphique Web et en partie outil de ligne de commande basé sur Python, PhosCoFinder a permis à l'équipe de rechercher rapidement dans l'ensemble de tous les GPCR connus et de prédire les codes de phosphorylation potentiels.
Comme prévu, plus de la moitié des 825 GPCR scannés par PhosCoFinder contiennent des codes de phosphorylation dans leur queue C-terminale, une partie du GPCR qui aide à transférer les informations de l'environnement de la cellule vers l'intérieur de la cellule. La plupart des GPCR restants se sont également avérés avoir des codes ; cependant, ils étaient situés dans des zones autres que leurs queues C-terminales, affectant peut-être la façon dont ils se lient aux arrestations. Les prochaines étapes, Xu dit, sont d'étudier si ces résultats sont vrais dans tous les GPCR et autres protéines de surface cellulaire qui interagissent avec l'arrestine.
"Avec la biologie, il y a toujours plus d'une façon de faire les choses, ", a déclaré Xu. "Nous voulons également suivre ces autres voies dans l'espoir qu'elles nous aident à mieux comprendre ces mécanismes critiques."