Si nous voulons ralentir le réchauffement climatique, nous devons réduire drastiquement les émissions de gaz à effet de serre. Entre autres choses, nous devons nous passer des combustibles fossiles et utiliser des technologies plus économes en énergie.
Cependant, la réduction des émissions à elle seule ne suffira pas à atteindre les objectifs climatiques. Nous devons également capter de grandes quantités de gaz à effet de serre CO2 de l'atmosphère et soit le stocker en permanence sous terre, soit l'utiliser comme matière première neutre en carbone dans l'industrie. Malheureusement, les technologies de capture du carbone disponibles aujourd'hui nécessitent beaucoup d'énergie et sont par conséquent coûteuses.
C'est pourquoi des chercheurs de l'ETH Zurich développent une nouvelle méthode utilisant la lumière. Grâce à ce procédé, à l’avenir, l’énergie nécessaire au captage du carbone proviendra du soleil. Leurs travaux ont été publiés dans Chemistry of Materials .
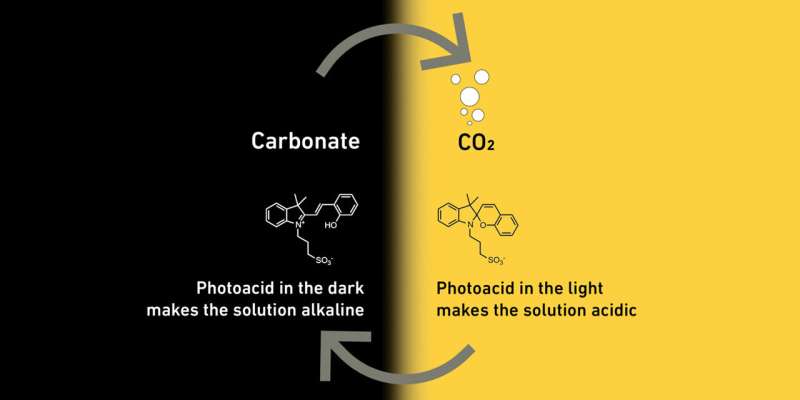
Dirigés par Maria Lukatskaya, professeur de systèmes énergétiques électrochimiques, les scientifiques exploitent le fait que dans les liquides aqueux acides, le CO2 est présent sous forme de CO2 , mais dans les liquides aqueux alcalins, il réagit pour former des sels d'acide carbonique, appelés carbonates. Cette réaction chimique est réversible. L'acidité d'un liquide détermine s'il contient du CO2 ou un carbonate.
Pour influencer l'acidité de leur liquide, les chercheurs y ont ajouté des molécules, appelées photoacides, qui réagissent à la lumière. Si ce liquide est ensuite irradié par la lumière, les molécules le rendent acide. Dans l'obscurité, ils reviennent à leur état d'origine, ce qui rend le liquide plus alcalin.
Voici comment fonctionne en détail la méthode des chercheurs de l'ETH :les chercheurs séparent le CO2 de l'air en faisant passer l'air à travers un liquide contenant des photoacides dans l'obscurité. Puisque ce liquide est alcalin, le CO2 réagit et forme des carbonates. Dès que les sels présents dans le liquide se sont accumulés de manière significative, les chercheurs irradient le liquide avec de la lumière. Cela le rend acide et les carbonates se transforment en CO2 .
Le CO2 des bulles sortent du liquide, comme dans une bouteille de cola, et peuvent être collectées dans des réservoirs d’essence. Quand il n'y a pratiquement pas de CO2 laissé dans le liquide, les chercheurs éteignent la lumière et le cycle recommence, avec le liquide prêt à capter le CO2 .
En pratique, cependant, un problème se posait :les photoacides utilisés sont instables dans l’eau. "Au cours de nos premières expériences, nous avons réalisé que les molécules se décomposeraient au bout d'un jour", explique Anna de Vries, doctorante du groupe de Lukatskaya et auteur principal de l'étude.
Lukatskaya, de Vries et leurs collègues ont donc analysé la désintégration de la molécule. Ils ont résolu le problème en effectuant leur réaction non pas dans l’eau mais dans un mélange d’eau et d’un solvant organique. Les scientifiques ont pu déterminer le rapport optimal des deux liquides grâce à des expériences en laboratoire et ont pu expliquer leurs résultats grâce à des modèles de calcul effectués par des chercheurs de l'Université de la Sorbonne à Paris.
D’une part, ce mélange leur a permis de maintenir les molécules photoacides stables dans la solution pendant près d’un mois. D'autre part, cela garantissait que la lumière pouvait être utilisée pour faire basculer la solution selon les besoins entre le mode acide et le mode alcalin. Si les chercheurs utilisaient le solvant organique sans eau, la réaction serait irréversible.
D’autres processus de captage du carbone sont également cycliques. Une méthode établie fonctionne avec des filtres qui collectent le CO2 molécules à température ambiante. Pour éliminer ensuite le CO2 des filtres, ceux-ci doivent être chauffés à environ 100° Celsius. Cependant, le chauffage et le refroidissement sont gourmands en énergie :ils représentent la majeure partie de l'énergie requise par la méthode de filtration.
"En revanche, notre processus ne nécessite ni chauffage ni refroidissement, il nécessite donc beaucoup moins d'énergie", explique Lukatskaya. De plus, la nouvelle méthode des chercheurs de l'ETH fonctionne potentiellement uniquement avec la lumière du soleil.
"Un autre aspect intéressant de notre système est que nous pouvons passer d'alcalin à acide en quelques secondes et revenir à alcalin en quelques minutes. Cela nous permet de basculer entre la capture et la libération du carbone beaucoup plus rapidement que dans un système piloté par la température", explique de Vries.
Avec cette étude, les chercheurs ont montré que les photoacides pouvaient être utilisés en laboratoire pour capter le CO2 . La prochaine étape vers la maturité commerciale consistera à accroître encore la stabilité des molécules photoacides. Ils doivent également étudier les paramètres de l'ensemble du processus pour l'optimiser davantage.
Plus d'informations : Anna de Vries et al, Photoacide réglé par solvation en tant que commutateur de pH stable piloté par la lumière pour la capture et la libération du CO2, Chimie des matériaux (2023). DOI :10.1021/acs.chemmater.3c02435
Informations sur le journal : Chimie des matériaux
Fourni par l'ETH Zurich