De nombreux organismes peuvent produire des minéraux ou des tissus minéralisés. Un exemple bien connu est la nacre, utilisée en bijouterie en raison de ses couleurs irisées. Chimiquement parlant, sa formation commence lorsqu'un mollusque extrait les ions calcium et carbonate de l'eau. Cependant, les processus et conditions exacts qui conduisent à la nacre, un composite de biopolymères et de plaquettes de carbonate de calcium cristallin, font l'objet d'intenses débats parmi les experts, et différentes théories existent.
Les chercheurs conviennent que les intermédiaires non cristallins, tels que le carbonate de calcium amorphe (ACC), jouent un rôle crucial dans la biominéralisation. Les homards et autres crustacés, par exemple, conservent une réserve d'ACC dans leur estomac, qu'ils utilisent pour construire une nouvelle coquille après la mue. Dans une étude récente publiée dans Nature Communications , des chercheurs de l'Université de Constance et de l'Université Leibniz de Hanovre ont réussi à déchiffrer le parcours de formation de l'ACC.
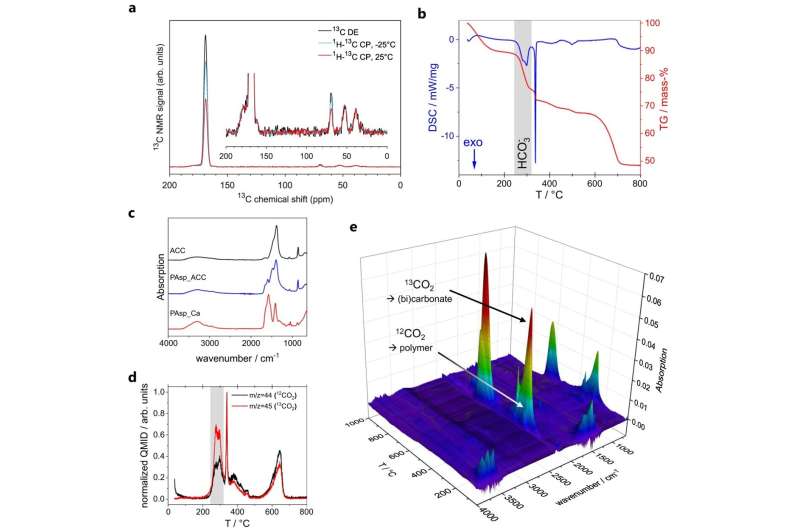
Les chercheurs dirigés par Denis Gebauer (Université Leibniz de Hanovre) et Guenièvre Mathies (Université de Constance) ont profité du fait que l'ACC peut être synthétisée non seulement par des organismes vivants, mais également en laboratoire. À l'aide de méthodes avancées telles que la spectroscopie de résonance magnétique nucléaire à rotation à angle magique (RMN MAS), ils ont analysé de minuscules particules d'ACC pour déterminer leur structure.
"Nous avons eu du mal à interpréter les spectres de l'ACC. Ils suggéraient des dynamiques que nous étions incapables de modéliser au début", explique Mathies.
Les collègues de l’Université Leibniz de Hanovre ont fourni un indice important. Maxim Gindele du groupe Gebauer a montré que l'ACC conduit l'électricité. Étant donné que les particules ACC sont très fragiles et ne mesurent que quelques dizaines de nanomètres, cela n'était pas aussi simple que d'y insérer deux fils.
Au lieu de cela, les mesures ont été effectuées à l’aide de la microscopie à force atomique à conductivité (C-AFM), dans laquelle les particules ACC sur une surface plane sont détectées par un minuscule porte-à-faux balayant la surface et visualisées à l’aide d’un faisceau laser. Lorsque le cantilever est placé sur l'une des nanoparticules, un courant passe à travers sa pointe pour mesurer la conductivité.
Informé par l'observation de la conductivité, Sanjay Vinod Kumar du groupe Mathies a réalisé d'autres expériences MAS RMN visant à sonder la dynamique. Ils ont indiqué deux environnements chimiques distincts dans les particules ACC. Dans le premier environnement, les molécules d’eau sont noyées dans du carbonate de calcium rigide et ne peuvent subir que des retournements à 180 degrés. Le deuxième environnement est constitué de molécules d'eau soumises à une lente culbutation et translation, avec des ions hydroxyde dissous.
"Le défi restant était de concilier les deux environnements avec la conductivité observée. Les sels solides sont des isolants et le deuxième environnement mobile devait donc jouer un rôle", explique Mathies. Dans le nouveau modèle, les molécules d'eau mobiles forment un réseau à travers les nanoparticules ACC. Les ions hydroxyde dissous portent la charge.
Les chercheurs peuvent également expliquer la formation de deux environnements chimiques :dans l’eau, les ions calcium et carbonate ont tendance à se coller et à former des assemblages dynamiques appelés amas de pré-nucléation. Les amas peuvent subir une séparation de phase et former des gouttelettes liquides denses, qui à leur tour fusionnent en agrégats plus grands, de la même manière que les bulles de savon fusionnent.
"L'environnement rigide et moins mobile naît du noyau des nanogouttelettes liquides denses. Le réseau de molécules d'eau mobiles, en revanche, reste dû à une coalescence imparfaite des surfaces des gouttelettes lors de la déshydratation vers un ACC solide", explique Gebauer.
Ces résultats constituent une étape importante vers un modèle structurel pour l’ACC. En même temps, ils fournissent des preuves solides que la minéralisation commence par des amas de pré-nucléation. "Cela nous rapproche non seulement de la compréhension du secret de la biominéralisation, mais peut également avoir des applications dans le développement de matériaux cimentaires qui lient le dioxyde de carbone et, puisque nous savons maintenant que l'ACC est un conducteur, dans des dispositifs électrochimiques", conclut Mathies.
Plus d'informations : Maxim B. Gindele et al, Les voies colloïdales de formation de carbonate de calcium amorphe conduisent à des environnements aquatiques et à une conductivité distincts, Nature Communications (2024). DOI : 10.1038/s41467-023-44381-x
Informations sur le journal : Communications naturelles
Fourni par l'Université de Constance