Une réaction chimique clé, dans laquelle le mouvement des protons entre la surface d'une électrode et un électrolyte entraîne un courant électrique, est une étape critique dans de nombreuses technologies énergétiques, notamment les piles à combustible et les électrolyseurs utilisés pour produire de l'hydrogène gazeux.
Pour la première fois, des chimistes du MIT ont cartographié en détail comment ces transferts d'électrons couplés à des protons se produisent à la surface d'une électrode. Leurs résultats pourraient aider les chercheurs à concevoir des piles à combustible, des batteries ou d'autres technologies énergétiques plus efficaces.
Le document de recherche est publié dans la revue Nature Chemistry. .
"Notre avancée dans cet article a consisté à étudier et à comprendre la nature de la façon dont ces électrons et protons se couplent sur un site de surface, ce qui est pertinent pour les réactions catalytiques importantes dans le contexte des dispositifs de conversion d'énergie ou des réactions catalytiques", explique Yogesh Surendranath, chercheur. professeur de chimie et de génie chimique au MIT et auteur principal de l'étude.
Parmi leurs découvertes, les chercheurs ont pu retracer exactement comment les changements de pH de la solution électrolytique entourant une électrode affectent la vitesse de mouvement des protons et le flux d'électrons dans l'électrode.
Noah Lewis, étudiant diplômé du MIT, est l'auteur principal de l'article. Ryan Bisbey, ancien postdoctorant au MIT; Karl Westendorff, étudiant diplômé du MIT; et Alexander Soudackov, chercheur scientifique à l'Université de Yale, sont également les auteurs de l'article.
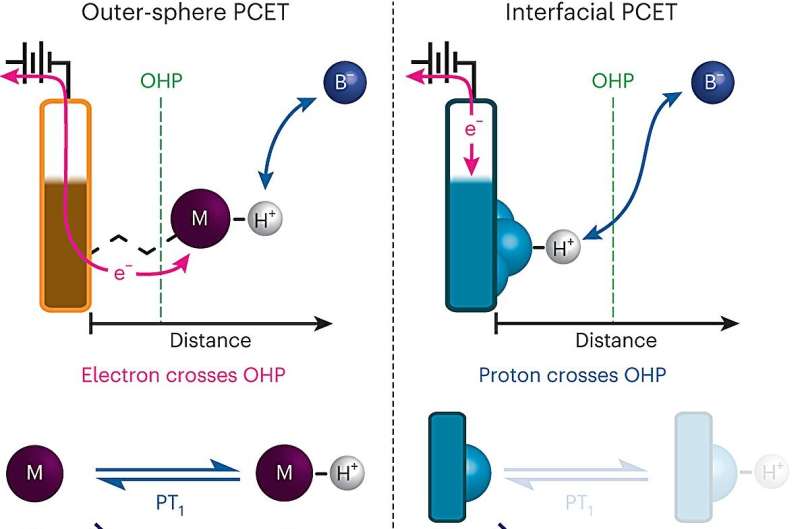
Le transfert d'électrons couplé à un proton se produit lorsqu'une molécule, souvent de l'eau ou un acide, transfère un proton à une autre molécule ou à la surface d'une électrode, ce qui stimule l'accepteur de proton à absorber également un électron. Ce type de réaction a été exploité pour de nombreuses applications énergétiques.
"Ces réactions de transfert d'électrons couplées à des protons sont omniprésentes. Elles constituent souvent des étapes clés dans les mécanismes catalytiques et sont particulièrement importantes pour les processus de conversion d'énergie tels que la génération d'hydrogène ou la catalyse des piles à combustible", explique Surendranath.
Dans un électrolyseur générateur d’hydrogène, cette approche est utilisée pour éliminer les protons de l’eau et ajouter des électrons aux protons pour former de l’hydrogène gazeux. Dans une pile à combustible, l'électricité est générée lorsque les protons et les électrons sont retirés de l'hydrogène gazeux et ajoutés à l'oxygène pour former de l'eau.
Le transfert d'électrons couplé à des protons est courant dans de nombreux autres types de réactions chimiques ; par exemple, la réduction du dioxyde de carbone (la conversion du dioxyde de carbone en carburants chimiques par ajout d'électrons et de protons). Les scientifiques ont beaucoup appris sur la façon dont ces réactions se produisent lorsque les accepteurs de protons sont des molécules, car ils peuvent contrôler avec précision la structure de chaque molécule et observer comment les électrons et les protons passent entre eux.
Cependant, lorsque le transfert d'électrons couplé à un proton se produit à la surface d'une électrode, le processus est beaucoup plus difficile à étudier car les surfaces des électrodes sont généralement très hétérogènes, avec de nombreux sites différents auxquels un proton pourrait potentiellement se lier.
Pour surmonter cet obstacle, l’équipe du MIT a développé un moyen de concevoir des surfaces d’électrodes qui leur permet de contrôler beaucoup plus précisément la composition de la surface de l’électrode. Leurs électrodes sont constituées de feuilles de graphène avec des composés organiques contenant des anneaux attachés à la surface. À l'extrémité de chacune de ces molécules organiques se trouve un ion oxygène chargé négativement qui peut accepter les protons de la solution environnante, ce qui provoque le flux d'un électron du circuit vers la surface graphitique.
"Nous pouvons créer une électrode qui ne consiste pas en une grande diversité de sites, mais constitue un ensemble uniforme d'un seul type de sites très bien définis pouvant chacun se lier à un proton avec la même affinité", explique Surendranath. "Comme nous disposons de sites très bien définis, cela nous a permis de vraiment comprendre la cinétique de ces processus."
Grâce à ce système, les chercheurs ont pu mesurer le flux de courant électrique vers les électrodes, ce qui leur a permis de calculer le taux de transfert de protons vers l'ion oxygène à la surface à l'équilibre - l'état dans lequel les taux de don de protons à la surface et le transfert de protons vers la solution depuis la surface sont égaux. Ils ont découvert que le pH de la solution environnante a un effet significatif sur ce taux :les taux les plus élevés se situent aux extrémités de l'échelle de pH : pH 0, le plus acide, et pH 14, le plus basique.
Pour expliquer ces résultats, les chercheurs ont développé un modèle basé sur deux réactions possibles pouvant se produire au niveau de l’électrode. Dans le premier, les ions hydronium (H 3 O + ), qui sont en forte concentration dans des solutions fortement acides, délivrent des protons à la surface des ions oxygène, générant de l'eau. Dans la seconde, l'eau délivre des protons aux ions oxygène de la surface, générant des ions hydroxyde (OH - ), qui sont en forte concentration dans des solutions fortement basiques.
Cependant, le taux à pH 0 est environ quatre fois plus rapide qu'à pH 14, en partie parce que l'hydronium abandonne des protons à un rythme plus rapide que l'eau.
Les chercheurs ont également découvert, à leur grande surprise, que les deux réactions ont des vitesses égales non pas à pH neutre 7, où les concentrations d'hydronium et d'hydroxyde sont égales, mais à pH 10, où la concentration d'ions hydroxyde est 1 million de fois celle de l'hydronium. Le modèle suggère que cela est dû au fait que la réaction directe impliquant le don de protons provenant de l'hydronium ou de l'eau contribue davantage au taux global que la réaction inverse impliquant l'élimination des protons par l'eau ou l'hydroxyde.
Les modèles existants sur la façon dont ces réactions se produisent à la surface des électrodes supposent que les réactions vers l'avant et vers l'arrière contribuent de manière égale au taux global. Les nouveaux résultats suggèrent donc que ces modèles pourraient devoir être reconsidérés, disent les chercheurs.
"C'est l'hypothèse par défaut, selon laquelle les réactions directes et inverses contribuent de manière égale au taux de réaction", explique Surendranath. "Notre découverte est vraiment révélatrice car elle signifie que l'hypothèse selon laquelle les gens utilisent pour tout analyser, de la catalyse des piles à combustible à l'évolution de l'hydrogène, pourrait être quelque chose que nous devons revoir."
Les chercheurs utilisent maintenant leur configuration expérimentale pour étudier comment l'ajout de différents types d'ions à la solution électrolytique entourant l'électrode peut accélérer ou ralentir le débit d'électrons couplés aux protons.
"Avec notre système, nous savons que nos sites sont constants et ne s'influencent pas les uns les autres, nous pouvons donc lire l'effet du changement dans la solution sur la réaction à la surface", explique Lewis.
Plus d'informations : Noah B. Lewis et al, Un cadre mécanistique au niveau moléculaire pour la cinétique de transfert d'électrons couplés à des protons interfaciaux, Nature Chemistry (2024). DOI :10.1038/s41557-023-01400-0
Informations sur le journal : Chimie naturelle
Fourni par le Massachusetts Institute of Technology
Cette histoire est republiée avec l'aimable autorisation de MIT News (web.mit.edu/newsoffice/), un site populaire qui couvre l'actualité de la recherche, de l'innovation et de l'enseignement du MIT.