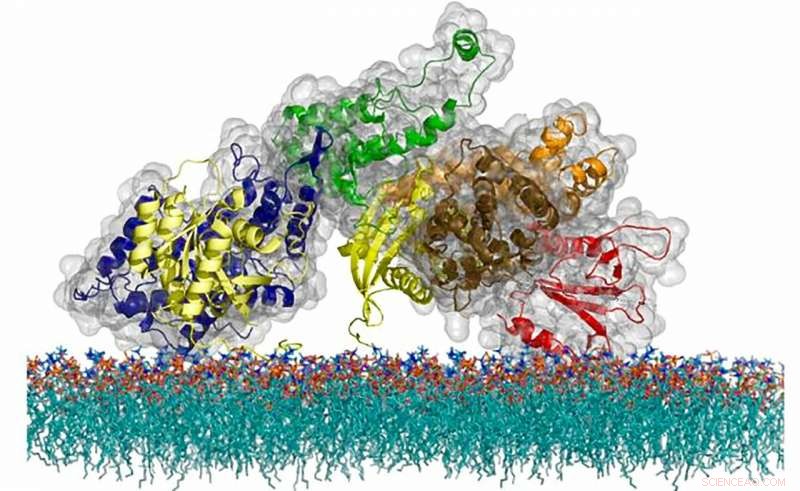
La structure atomique de la protéine SOS, une molécule de messagerie cellulaire qui utilise un mécanisme de synchronisation unique pour réguler l'activation d'une voie critique du système immunitaire. Crédit :Steven Alvarez/Laboratoire de Berkeley
Pour la toute première fois, les scientifiques ont imaginé le processus par lequel une molécule individuelle du système immunitaire est activée en réponse à un signal de l'environnement, menant à la découverte critique que le processus d'activation implique des centaines de protéines se réunissant soudainement pour former un réseau lié par un processus connu sous le nom de transition de phase.
Le nouveau travail, décrit dans un article récemment publié dans Science , fournit un énorme bond en avant dans notre compréhension de la façon dont le système immunitaire est finement réglé pour détecter même une seule molécule de virus au milieu d'une mer de millions d'autres molécules, nous permettant de nous remettre rapidement d'infections virales telles que la grippe. En apprenant comment fonctionnent ces protéines particulières, les scientifiques comprendront également mieux pourquoi leur activité tourne parfois mal - des événements qui peuvent conduire à des maladies auto-immunes, comme le diabète ou la polyarthrite rhumatoïde - et peut fournir des informations uniques sur la façon de diriger le système immunitaire d'un patient atteint de cancer pour guérir le cancer.
« C'est quelque chose qui se produit à l'intérieur d'une cellule vivante pendant le processus de prise de décision de la cellule - la transduction du signal est ce que nous appelons - et c'est ainsi que les cellules « pensent » avec des réactions chimiques, " a déclaré le responsable de l'étude Jay Groves, un professeur de chimie dans le domaine des biosciences du laboratoire national Lawrence Berkeley du département de l'énergie (Berkeley Lab). « Dans le domaine de la biologie dans son ensemble, l'idée d'une transition de phase de condensation des protéines a récemment attiré beaucoup d'attention. De nombreux groupes dans le monde étudient ces phénomènes, mais jusqu'à maintenant, personne ne savait comment ni pourquoi la cellule les utilise.
"Notre papier est, Je crois, le premier à tester et confirmer directement comment une transition de phase peut réguler la signalisation, " dit Groves. " Et la grande découverte est qu'il s'agit d'un mécanisme de synchronisation moléculaire. La cellule utilise le temps pour distinguer une véritable stimulation du récepteur du bruit chimique de fond."
Étudier un messager cellulaire essentiel
La révélation de l'équipe est survenue dans le cadre des recherches en cours du laboratoire Groves sur les mécanismes physiques de la signalisation des cellules T et de la protéine Ras. Trouvé dans toutes les cellules eucaryotes dans de multiples variations, Ras porte plusieurs chapeaux, notamment en agissant comme régulateur de la croissance cellulaire, division, et la mort. cellules T, les cellules du système immunitaire qui détectent les infections étrangères et potentiellement nocives, utilisez Ras comme interrupteur marche-arrêt pour la voie d'alerte d'intrusion qui lance une réponse de protection. La capacité de la cellule T à distinguer un signal externe réel - lorsqu'une molécule étrangère se lie au récepteur des cellules T (TCR) bien nommé à la surface de la cellule - d'un contact accidentel avec des protéines voisines est essentielle au bon fonctionnement du système immunitaire. Si une cellule T réagit accidentellement à l'une de nos propres molécules, alors une maladie auto-immune peut se développer. À la fois, si une cellule T perd sa sensibilité, alors les virus pourront se développer sans contrôle et les cellules cancéreuses ne seront pas éliminées du corps.
En raison des vastes implications pour la santé humaine, les scientifiques se demandent depuis longtemps comment les cellules régulent leurs signaux afin d'atteindre cet équilibre. Des recherches antérieures avaient révélé que les protéines Ras d'une cellule T n'interagissent pas directement avec les récepteurs cellulaires. Au lieu, les récepteurs envoient le signal « on » aux protéines intermédiaires internes, comprenant un groupe clé de trois protéines, connu sous le nom de LAT, Grb2, et SOS, qui finalement passent le signal à Ras. Avant cette étude, les scientifiques savaient que ce trio moléculaire pouvait se lier dans un processus de transition de phase, mais personne ne savait ce que faisait la transition de phase. Et jusqu'à récemment, c'était impossible à comprendre, car aucune technologie ne permettait aux scientifiques de surveiller directement l'activité de molécules individuelles dans des systèmes membranaires cellulaires complexes.
L'équipe de recherche a levé cet obstacle en inventant une approche basée sur des puces à membrane supportées, une technologie que l'équipe développe depuis de nombreuses années et qui utilise des échafaudages constitués de structures nanofabriquées pour maintenir les membranes cellulaires.
Transitions de phase au travail
Dans l'étude actuelle, les scientifiques ont utilisé la microscopie pour observer le moment où un récepteur de cellule T sur une puce à membrane supportée a demandé à une seule molécule SOS de s'activer. Au lieu de répondre tout de suite, SOS a attendu 10 à 30 secondes avant de passer à son état actif. Si les molécules voisines LAT et Grb2 ont subi la transition de phase avec SOS, et condensés dans leur état assemblé, ils pourraient maintenir le SOS sur la membrane assez longtemps pour que le SOS s'active. Sans transition de phase, le long délai de la molécule SOS l'empêcherait de s'activer avant qu'elle ne quitte le récepteur.
"C'est comme si la protéine avait un retard intégré, " a expliqué Groves. " Il a besoin de la transition de phase combinée à une signalisation soutenue, et ce n'est qu'alors qu'il s'allumera."
Bien que cette recherche soit spécifique à la signalisation des lymphocytes T, Groves et ses collègues pensent que des mécanismes de synchronisation de transition de phase similaires sont probablement impliqués dans une variété d'autres réponses cellulaires. Maintenant qu'ils ont établi une technique expérimentale éprouvée pour observer l'activation moléculaire de tels processus, l'équipe espère démêler des mystères plus anciens sur la façon dont les cellules effectuent tant de tâches complexes.