Une nouvelle étude visait à comprendre comment notre corps reconnaît et répond à différentes formes énantiomères d'opioïdes. Dirigée par le Dr Xiaohui Wang de l'Institut de chimie appliquée de Changchun, Académie chinoise des sciences, la recherche a été publiée dans la revue National Science Review. .
Dans les années 1950, on a remarqué que l’efficacité des stupéfiants opiacés dépend fortement de leur stéréochimie. Les formes actives sont les isomères (-), tandis que les isomères (+) n'ont aucun effet analgésique. La morphine, un analgésique puissant dérivé du pavot à opium, se présente naturellement sous la forme isomère (-). Cependant, la (+)-morphine synthétique a une activité minimale et ne soulage pas la douleur. Cela montre que le récepteur μ-opioïde (MOR) répond sélectivement aux énantiomères de la morphine.
Le Dr Wang déclare : « Cela constitue une question déroutante en neurosciences et en pharmacologie depuis un demi-siècle :pourquoi la (-)-morphine naturelle soulage-t-elle la douleur alors que la (+)-morphine ne le fait pas ? »
Les progrès récents en biologie structurale ont permis aux scientifiques d’examiner les structures à haute résolution du MOR, permettant ainsi d’étudier sa stéréosélectivité au niveau atomique. De plus, les simulations de dynamique moléculaire ont considérablement amélioré notre capacité à disséquer la thermodynamique et la cinétique des interactions récepteur-ligand.
Le Dr Wang ajoute :« Le développement de nouvelles technologies nous a donné un coup de pouce supplémentaire dans la compréhension de la manière dont MOR reconnaît et répond aux différentes formes énantiomères de morphine. »
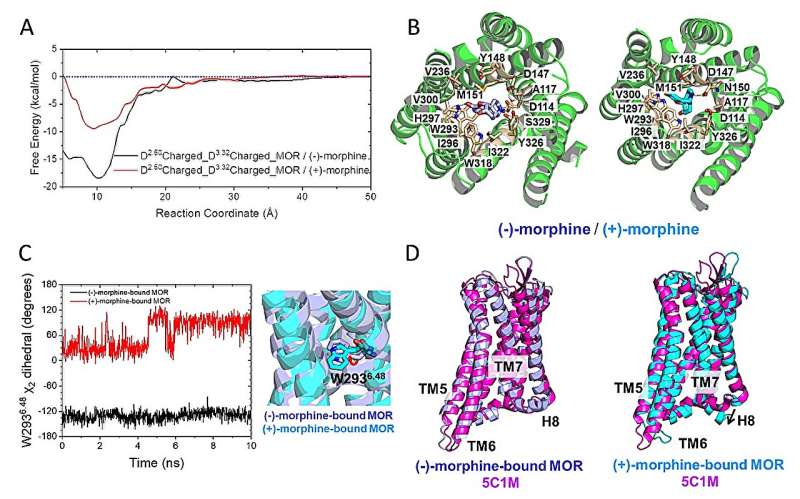
Dans cette étude, les chercheurs ont utilisé des simulations informatiques pour explorer les mécanismes thermodynamiques et cinétiques de la reconnaissance stéréosélective de la morphine par MOR par des simulations MD entièrement atomiques. Ils ont découvert que la liaison de la (-)-morphine stabilise le MOR dans son état activé, présentant un puits d'énergie profond, entraînant ainsi un soulagement de la douleur.
À l'inverse, la (+)-morphine ne parvient pas à maintenir l'activation de MOR. L'étude a également identifié des régions spécifiques du MOR qui subissent des changements lors de la liaison à la (-)-morphine.
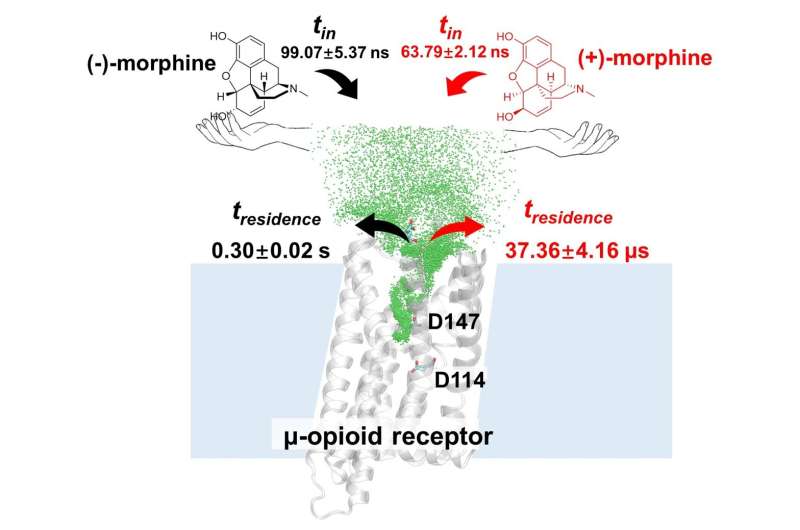
"La sélectivité de la reconnaissance moléculaire va au-delà des affinités de liaison et s'étend au domaine du temps de séjour", explique le Dr Wang. Dans cette étude, l'analyse de la cinétique met en lumière la capacité de reconnaissance chirale du MOR, comme en témoigne le temps de séjour.
Notamment, la (-)-morphine a démontré un temps de séjour plus long que la (+)-morphine dans le MOR, d'un facteur remarquable de 8 000. Ces résultats cinétiques sont conformes aux preuves expérimentales démontrant que la (-)-morphine fonctionne comme un agoniste du MOR tandis que la (+)-morphine présente une affinité minimale pour le MOR.
En élucidant la thermodynamique et la cinétique derrière la reconnaissance stéréosélective des énantiomères de la morphine par MOR, cette étude offre des informations précieuses sur le fonctionnement fondamental du système opioïde. Les connaissances acquises grâce à cette recherche peuvent potentiellement contribuer au développement d'analgésiques plus efficaces et ciblés avec des effets secondaires réduits.
Le Dr Wang et son équipe estiment que leurs découvertes jettent les bases d'études plus approfondies sur le MOR et ses interactions avec diverses molécules chirales. Cette recherche a le potentiel d'ouvrir de nouvelles voies dans les domaines des neurosciences et de la pharmacologie.
En approfondissant la manière dont MOR interagit avec ces molécules, l’équipe prévoit de découvrir de nouvelles informations sur le comportement des récepteurs, ce qui pourrait conduire à des progrès dans le développement de médicaments, en particulier dans la gestion de la douleur et le traitement de la toxicomanie. De telles explorations sont cruciales pour comprendre les nuances des interactions récepteur-ligand et pourraient à terme contribuer à des stratégies thérapeutiques plus efficaces et ciblées.
Plus d'informations : Yibo Wang et al, Reconnaissance stéréosélective des énantiomères de la morphine par le récepteur μ-opioïde, National Science Review (2024). DOI : 10.1093/nsr/nwae029
Fourni par Science China Press