Dans la plupart des réactions chimiques industrielles, les catalyseurs se combinent aux matières premières et les accompagnent tout au long des étapes intermédiaires jusqu'au produit. En chimie, cette voie est connue sous le nom de mécanisme réactionnel, et c'est une sorte de boîte noire :personne ne sait au début ce qui se passe au niveau moléculaire.
Si le résultat de la réaction en laboratoire n’est pas à la hauteur des attentes, les chimistes ont d’abord recours à des essais et des erreurs. En termes simples, ils modifient la réaction jusqu'à ce qu'elle fonctionne. Parfois, cependant, il vaut la peine d'examiner de plus près le mécanisme de réaction, comme le montre le Dr Nora Jannsen de l'Institut Leibniz de catalyse à Rostock à l'aide d'un modèle de réaction.
Elle a récemment publié ses découvertes, obtenues dans le cadre de son doctorat, dans le Journal of the American Chemical Society. .
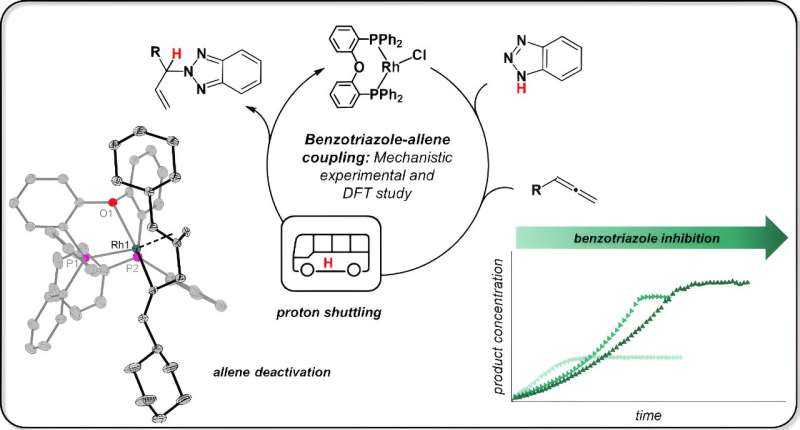
La réaction du modèle semble peu spectaculaire et surtout étrange à l'oreille du profane, explique Jannsen. "Le benzotriazole, généralement un inhibiteur de corrosion, est converti en une nouvelle substance avec un allène (l'accent est ici mis sur la deuxième syllabe) à l'aide d'un catalyseur au rhodium." Celui-ci est alors appelé allylbenzotriazole et peut être utilisé dans diverses synthèses. La réaction a été développée par un groupe de recherche dirigé par le professeur Breit de l'Université de Fribourg.
Les collègues de Fribourg ont réussi à relier précisément un « groupe fonctionnel » à une position très spécifique dans le benzotrialzole. C'est là que se trouve une liaison azote-hydrogène (N-H), comme l'explique Jannsen.
Les "groupes fonctionnels" sont importants en tant que segments moléculaires car ils sont responsables de l'effet spécifique, par exemple pharmaceutique.
"L'équipe de Fribourg voulait placer un tel groupe dans le benzotriazole exactement là où se trouve la liaison N-H, et la liaison N-H doit céder la place pour cela", poursuit Jannsen. Les collègues ont réussi à le faire. "Mais ils n'ont pas compris sur quelle base ils étaient parvenus à cela."
C'est dommage. Car ce n’est qu’avec une compréhension des événements moléculaires que la réaction pourra être spécifiquement appliquée et optimisée à l’avenir. C'était l'objectif de la thèse de Jannsen, qu'elle a soutenue avec succès à Rostock en 2023.
Alors, comment fonctionne une telle réaction ? Le début et la fin sont connus. Ce que l’on sait également de cette réaction, c’est que chaque atome des matières premières se retrouve ensuite dans le produit ; les chimistes appellent cela une réaction « atomique-économique ». Cela signifie qu'au cours de la réaction, l'hydrogène de la liaison N-H doit passer du benzotriazole au deuxième matériau de départ, l'allène.
Jannsen dit :"Les scientifiques de Fribourg pensaient que le catalyseur rompait la liaison azote-hydrogène, c'est-à-dire qu'une soi-disant addition oxydante du benzotriazole avait lieu. Les catalyseurs au rhodium sont connus pour ce type de réaction."
Jannsen a testé l'idée en faisant d'abord réagir le catalyseur au rhodium avec un seul matériau de départ, le benzotriazole. Elle a isolé des échantillons de cette réaction pour la spectroscopie de résonance magnétique nucléaire (RMN) et l'analyse de la structure cristalline aux rayons X. Résultat :"La liaison N-H n'est pas du tout rompue. Le benzotriazole reste complètement intact, il se fixe uniquement sur le catalyseur."
Le chimiste a alors découvert que la deuxième substance de départ, Allen, se lie également au catalyseur. Et c'est là que se produit ce qui suit :« Les deux matières premières entrent en contact direct l'une avec l'autre et le benzotriazole transfère l'atome d'hydrogène, également appelé proton, à l'allène. Le catalyseur ne fait que maintenir les matières premières en place, mais n'intervient pas directement dans cette étape."
Jannsen a ensuite étayé cette proposition en détail en utilisant la mécanique quantique, c'est-à-dire en modélisant théoriquement le chemin de réaction.
Jannsen a été surpris que le catalyseur gère tout cela si simplement. Pour les profanes, cela peut ressembler un peu à un tour de corde chimique. En termes techniques, un tel processus est bien connu et s'appelle protonation.
Ce procédé présentait un avantage. Jannsen déclare:"Il est intéressant de noter que les conditions de réaction pour la protonation peuvent être considérablement améliorées en ajoutant une autre source de protons." Par exemple, elle a réussi à réduire la température de réaction de 80°C à température ambiante en ajoutant un type de co-catalyseur.
Jannsen a également découvert que le benzotriazole peut également bloquer le catalyseur dans certaines circonstances. C'est le cas lorsque cette substance de départ occupe deux fois le catalyseur, de sorte que son partenaire réactionnel, l'allen, ne peut pas trouver d'espace libre sur le catalyseur.
Cela paralyse l'activité catalytique et conduit à la « consommation » du catalyseur. "Il est probablement utile ici d'ajouter simplement le matériau de départ à la réaction successivement afin que le catalyseur entre moins en contact avec lui", explique Jannsen.
Plus d'informations : Nora Jannsen et al, Le mécanisme du couplage catalysé Rh(I) des benzotriazoles et des allènes revisité :inhibition du substrat, navette de protons et rôle des espèces cationiques et neutres, Journal of the American Chemical Society (2024). DOI : 10.1021/jacs.4c02679
Informations sur le journal : Journal de l'American Chemical Society
Fourni par l'Institut Leibniz pour la catalyse