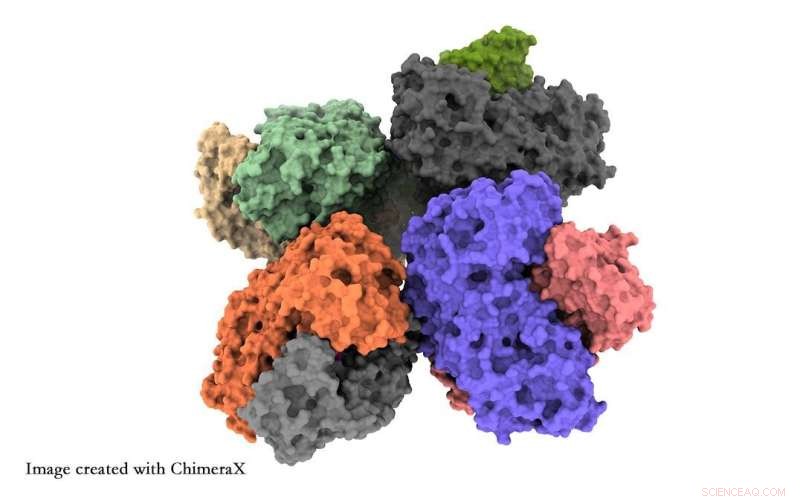
Des chercheurs de l'Université de Tsukuba ont obtenu des informations au niveau atomique sur la structure de l'enzyme phosphocétolase, ce qui aidera les chercheurs à optimiser cette enzyme pour la synthèse de matières premières chimiques. Crédit :Université de Tsukuba
Les industries pharmaceutiques, plastiques et autres utilisent des enzymes pour aider à synthétiser les matières premières moléculaires. Les enzymes extraites directement de microbes tels que les bactéries ne sont souvent pas optimales pour une utilisation industrielle; un problème est qu'ils ne survivent souvent pas aux températures élevées qui accélèrent une synthèse. Le génie génétique peut aider à adapter les enzymes à ces fins. La connaissance de la structure exacte atome par atome de l'enzyme d'origine est importante pour comprendre la fonction enzymatique dans la nature, fournissant ainsi un aperçu de la façon d'optimiser le génie génétique des enzymes. Cependant, la cristallographie aux rayons X, une technique courante pour déterminer la structure d'une enzyme en tant qu'étape critique de ce processus, peut malheureusement également modifier sa structure.
Une technique connue sous le nom de microscopie électronique cryogénique (cryo-EM) peut fournir un niveau de détail structurel similaire à celui de la cristallographie aux rayons X tout en conservant la structure de l'enzyme native. En fait, le prix Nobel de chimie 2017 a été décerné pour l'utilisation de cette technique pour déterminer la structure des molécules biologiques. Maintenant, dans une étude récemment publiée dans le Journal of Structural Biology , des chercheurs de l'Université de Tsukuba et des partenaires collaborateurs ont utilisé la cryo-EM pour déterminer la structure de l'enzyme de fermentation phosphocétolase. Ce travail facilitera le génie génétique de l'enzyme pour les synthèses industrielles.
"La cristallographie aux rayons X a révolutionné la façon dont les chercheurs identifient les structures des protéines, mais le développement de moyens alternatifs qui reflètent mieux les structures observées en biologie est inestimable", explique l'auteur principal, le professeur Kenji Iwasaki. "Notre utilisation de la cryo-EM comme outil d'imagerie a révélé des détails structurels auparavant obscurcis dans la phosphocétolase qui profiteront directement à l'industrie chimique."
Les chercheurs rapportent deux résultats principaux. Premièrement, huit unités de phosphocétolase se regroupent en une seule structure, connue sous le nom d'octamère. Deuxièmement, ils ont observé les détails d'une chaîne d'acides aminés connue sous le nom de boucle QN qui peut dicter si le site fonctionnel de l'enzyme est ouvert ou fermé. Il s'agit d'un moyen possible d'améliorer la production chimique de l'enzyme.
La cristallographie aux rayons X obscurcit les détails structurels fournis par la cryo-EM. L'octamère était auparavant observé par cristallographie aux rayons X, mais on pensait qu'il s'agissait simplement d'un artefact de mesure. De plus, la cristallographie aux rayons X manque les détails structurels ouverts/fermés.
"L'industrie sera désormais en mesure de corréler la fonction de la phosphocétolase avec sa structure correcte", déclare Iwasaki. "Nous espérons que ces informations rappelleront aux chercheurs que la cristallographie aux rayons X n'est pas nécessairement le dernier mot sur la structure enzymatique ; la cryo-EM peut offrir des informations précieuses."
Les résultats de cette étude sont importants pour optimiser les performances d'une enzyme de fermentation utile pour la réalisation de synthèses chimiques dans l'industrie. En utilisant les connaissances structurelles enzymatiques pour maximiser le succès du génie génétique, des matières premières peuvent être produites pour les produits pharmaceutiques, les plastiques et d'autres matériaux de manière écologiquement durable. Les bactéries mangeuses de méthane convertissent les gaz à effet de serre en carburant