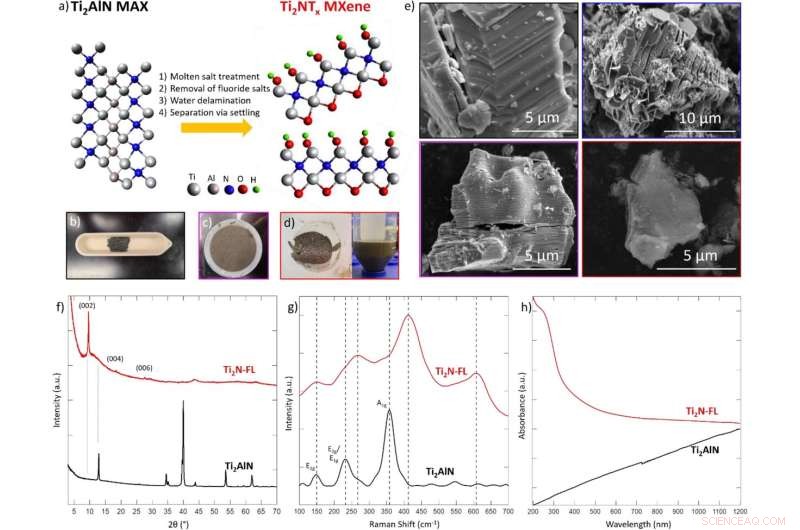
(a) Illustration schématique de la synthèse de Ti2NTx MXene par traitement au fluorure de sel fondu assisté par oxygène de la phase MAX parente Ti2AlN à 550 °C pendant 5 h sous argon en circulation, puis exposition à l'air, suivie d'une élimination du sel de fluorure dans 4 M H2SO4 , enfin la délamination est réalisée par sonication dans l'eau pendant 4 h. Les modèles ne sont pas basés sur des données recueillies, mais seulement comme une ligne directrice générale. Dans les photographies de laboratoire de (b) la phase MAX, (c) le MXène Ti2N multicouche après lavage à l'acide et (d) le MXène monocouche acquis après délaminage dans l'eau. (e) Imagerie SEM de la phase Ti2AlN MAX (contour noir), de la phase MAX traitée au sel fondu (contour bleu), du Ti2N MXene multicouche (contour violet) et de quelques couches de Ti2N MXene (contour rouge). La taille latérale des flocons de MXene individuels est d'environ 5 μm. ( f ) XRD, ( g ) Raman et ( h ) spectres UV – Vis de la phase Ti2AlN MAX (noir) et de la monocouche Ti2N MXene (rouge). XRD a été recueilli à l'aide d'une plaque de silicium à diffraction nulle avec un puits. La spectroscopie Raman a été recueillie à l'aide d'un laser à 532 nm à une puissance de 5 % avec un temps d'exposition de 1 s. La spectroscopie UV-Vis a été collectée en utilisant de l'eau comme matrice. Crédit :Rapports scientifiques (2022). DOI :10.1038/s41598-021-04640-7
L'ammoniac est couramment utilisé dans les engrais car il a la teneur en azote la plus élevée des engrais commerciaux, ce qui le rend essentiel pour la production agricole. Cependant, deux molécules de dioxyde de carbone sont fabriquées pour chaque molécule d'ammoniac produite, contribuant à l'excès de dioxyde de carbone dans l'atmosphère.
Une équipe du département de génie chimique Artie McFerrin de la Texas A&M University, composée du Dr Abdoulaye Djire, professeur adjoint, et de l'étudiant diplômé Denis Johnson, a mis au point une méthode de production d'ammoniac par des procédés électrochimiques, contribuant à réduire les émissions de carbone. Cette recherche vise à remplacer le procédé thermochimique Haber-Bosch par un procédé électrochimique plus durable et plus sûr pour l'environnement.
Les chercheurs ont récemment publié leurs découvertes dans Rapports scientifiques .
Depuis le début des années 1900, le procédé Haber-Bosch est utilisé pour produire de l'ammoniac. Ce processus fonctionne en faisant réagir de l'azote atmosphérique avec de l'hydrogène gazeux. Un inconvénient du procédé Haber-Bosch est qu'il nécessite une pression et une température élevées, ce qui laisse une grande empreinte énergétique. Le procédé nécessite également une charge d'alimentation en hydrogène, qui est dérivée de ressources non renouvelables. Il n'est pas durable et a des implications négatives sur l'environnement, ce qui accélère le besoin de nouveaux procédés respectueux de l'environnement.
Les chercheurs ont proposé d'utiliser la réaction électrochimique de réduction de l'azote (NRR) pour produire de l'ammoniac à partir d'azote et d'eau atmosphériques. Les avantages de l'utilisation d'une méthode électrochimique comprennent l'utilisation d'eau pour fournir des protons et la capacité de produire de l'ammoniac à température et pression ambiantes. Ce procédé nécessiterait potentiellement moins d'énergie et serait moins coûteux et plus respectueux de l'environnement que le procédé Haber-Bosch.
Le NRR fonctionne en utilisant un électrocatalyseur. Pour que ce processus réussisse, l'azote doit se lier à la surface et se décomposer pour produire de l'ammoniac. In this study, the researchers used MXene, a titanium nitride, as the electrocatalyst. What differentiates this catalyst from others is that nitrogen is already in its structure, allowing for more efficient ammonia formulation.
"It's easier for ammonia to form because the protons can attach to the nitrogen in the structure, form the ammonia and then the ammonia will leave out of the structure," said Johnson. "A hole is made in the structure that can pull the nitrogen gas in and separate the triple bond."
The researchers found that using titanium nitride induces a Mars-van Krevelen mechanism, a popular mechanism for hydrocarbon oxidation. This mechanism follows a lower energy pathway that would allow for higher ammonia production rates and selectivity because of the nitrogen from the titanium nitride catalyst.
Without modifications to the materials, the researchers reached a selectivity of 20%, which is the ratio of the desired product formed compared to the undesired product formed. Their method could potentially reach a higher selectivity percentage with modifications, forging a new pathway to ammonia production through electrochemical processes.
"The Department of Energy has set a goal of a selectivity of 60%, which is a challenging number to reach," said Johnson. "We were able to reach 20% using our material, showcasing a method that we might be able to take advantage of moving forward. If we upgrade our material, can we reach 60% soon? That is the question we will continue to work to answer."
This research could potentially reduce the carbon footprint and global energy usage on a larger scale.
"In the future, this could be a major scientific reform," said Djire. "About 2% of the world's total energy is used for ammonia production. Reducing that huge number would drastically reduce our carbon footprint and energy consumption."
Other contributors to the publication are Eric Kelley from the chemical engineering department at Texas A&M, Brock Hunter from Auburn University, and Jevaun Christie and Cullan King from Prairie View A&M University. The new alchemy in carbon neutrality:Turning water into ammonia with only renewable energy