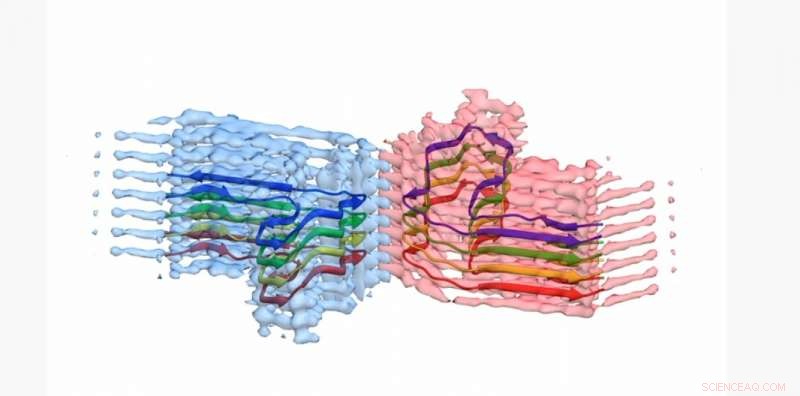
Une section d'une fibrille amyloïde b2m, avec le modèle atomique pour 8 copies de la protéine b2m intégrée dans la densité EM. La fibrille est constituée de deux « protofilaments » qui s'enroulent l'un autour de l'autre (bleu et rose). Cette section mesure environ 4 milliardièmes de mètre de long Crédit :Université de Leeds
La mission centenaire de comprendre comment les protéines responsables des maladies à base d'amyloïde comme la maladie d'Alzheimer, Les travaux de Huntingdon et de Parkinson ont fait des progrès importants au cours des 12 derniers mois, grâce à une révolution dans une technique de microscopie puissante utilisée par les scientifiques.
Des microscopes à haute puissance utilisant des électrons au lieu de la lumière pour « voir » la forme réelle des échantillons placés sous eux, à des niveaux de détail proches de l'atome, ne sont devenus disponibles que récemment pour les scientifiques britanniques.
Le Royaume-Uni a massivement investi dans les microscopes cryoélectroniques « qui changent la donne », mais il y a encore moins de 25 des instruments de plusieurs millions de livres dans les universités et instituts de recherche britanniques.
Les deux instruments de l'Université de Leeds, financé par l'Université elle-même et Wellcome, sont les seuls de leur genre dans le nord de l'Angleterre.
Ils ont déjà fait leurs preuves en tant qu'outil clé pour les scientifiques qui les ont utilisés dans de nombreux projets de recherche, mais viennent de remporter leur plus grand succès à ce jour :révéler la structure de l'amyloïde, une accumulation de protéines anormales dans le corps qui causent la maladie.
Il y a moins de 10 images et structures de bonne qualité de ces types de protéines disponibles à étudier dans le monde, les recherches de Leeds apportent donc une contribution significative à la compréhension des scientifiques sur la façon dont les protéines forment des agrégats et comment elles pourraient contribuer à la maladie amyloïde.
Les images et les structures 3D des agrégats de protéines, dont les scientifiques de Leeds ont montré qu'elles formaient de longues, fibres torsadées—a été publié dans la revue Communication Nature . La protéine impliquée - la β2-microglobuline - est normalement impliquée dans un système immunitaire sain, mais peut s'assembler dans les fibres amyloïdes causant la douleur chez les personnes qui subissent une dialyse à long terme pour une insuffisance rénale. Lorsqu'ils se logent dans les articulations des personnes, ils peuvent provoquer de l'arthrose
Il est prévu que les résultats seront utilisés par les fabricants de médicaments et les groupes de recherche à l'échelle internationale qui s'efforcent de financer des traitements contre les maladies amyloïdes de tous types.
Professeur Sheena Radford FMedSci, FRS et le professeur Neil Ranson du Centre universitaire de biologie moléculaire d'Astbury, a dirigé le programme de cinq ans pour imager les fibres protéiques et montrer leur structure en 3D.
Le couple était soutenu par des collègues de Leeds, Josh Boardman, qui à l'époque était un étudiant de premier cycle en biochimie.

Dr Rebecca Thompson, le directeur du centre de microscopie cryoélectronique de l'Université de Leeds charge un échantillon dans l'un des microscopes. Crédit :Université de Leeds
L'étude impliquait également une collaboration de longue date avec le professeur Bob Griffin, du Massachusetts Institute for Technology, qui se spécialise dans une autre méthode d'analyse biologique avancée de la matière biologique, la résonance magnétique nucléaire à l'état solide.
Le professeur Radford a déclaré :« Au cours des six dernières décennies, depuis la création des premières images de microscopie électronique d'amyloïde, les scientifiques sont passés du travail avec des images floues à basse résolution à nos images et structures 3D d'une netteté incroyable, grâce aux avancées modernes de la cryomicroscopie électronique.
« Maintenant, nous savons exactement où se situe chaque nœud et chaque point sur la protéine, nous pourrons peut-être développer des composés qui s'y verrouillent étroitement, ou le perturber, et découvrez comment les fibres contribuent à la maladie. C'est l'équivalent d'essayer de faire coller deux ballons ensemble à deux rouages qui tournent parfaitement l'un avec l'autre.
Elle a ajouté :« Nous avons utilisé la cryomicroscopie électronique non seulement pour découvrir la forme et la structure des protéines amyloïdes, mais aussi comment ils grandissent et s'entrelacent comme les stands dans une corde pour former des ensembles plus grands. Cette connaissance va être cruciale pour savoir comment les gérer. »
Le professeur Ranson a déclaré :« Jusqu'à il y a environ un an, les scientifiques savaient que la structure ressemblait plus ou moins à une échelle, mais nous avons maintenant montré que c'est beaucoup plus complexe que cela. Nous commençons maintenant à voir comment différentes protéines se replient sous différentes formes et comment celles-ci varient avec chaque maladie qu'elles provoquent.
« Les détails supplémentaires que nous avons découverts signifient que nous pouvons commencer à comprendre les capacités pathogènes de ces protéines.
Il a ajouté "Les fibres amyloïdes sont également connues pour avoir la résistance de l'acier, et, nous comprenons maintenant leurs structures. Nous pourrions peut-être fabriquer de nouveaux biomatériaux inspirés de leurs structures. C'est un excellent exemple où la cryo-microscopie électronique peut avoir des avantages supplémentaires."
Connaissant la structure de la protéine dans le niveau de détail fourni par les chercheurs de Leeds, et mesurer ces différences dans différents types de maladie amyloïde et différents patients, pourrait également permettre aux médecins de montrer qui serait le plus à risque, ce qui signifie que le traitement peut être ciblé sur ceux qui en ont le plus besoin.
La prochaine étape pour la communauté scientifique est de commencer à identifier et à développer des inhibiteurs - des composés qui peuvent contrôler l'assemblage des protéines en amyloïde. Le professeur Radford a obtenu près de 2 millions de livres sterling de Wellcome pour mener à bien cette étape de développement.
D'autres essais en laboratoire, essais cliniques, l'approbation réglementaire et la participation d'un développeur de médicaments seraient toujours nécessaires avant que les médicaments puissent être mis sur le marché, mais les avancées significatives dans la clarté de l'image et la compréhension de la structure de repliement amyloïde marquent un grand pas en avant.
L'article de recherche complet La structure d'une fibrille β2microglobuline suggère une base moléculaire pour son polymorphisme amyloïde est publié dans Communication Nature .