
Rendu artistique de la 3+3-cycloaddition. Crédit :Empa
Les synthèses chimiques dans les liquides et les gaz se déroulent dans un espace tridimensionnel. Des collisions aléatoires entre molécules doivent aboutir à quelque chose de nouveau en un temps extrêmement court. Mais il existe un autre moyen :sur une surface d'or dans des conditions d'ultravide, des molécules immobiles les unes à côté des autres peuvent être amenées à se combiner, même celles qui ne voudraient jamais réagir les unes avec les autres dans un liquide. Des chercheurs de l'Empa viennent de découvrir une telle réaction. Mieux encore, les experts peuvent "prendre des photos" et observer chaque étape de la réaction.
En chimie, il existe des structures particulièrement stables, comme le soi-disant "cycle benzénique" constitué de six atomes de carbone interconnectés. Ces anneaux forment la base structurelle du graphite et du graphène, mais ils sont également présents dans de nombreux colorants, tels que l'indigo pour jeans et dans de nombreux médicaments tels que l'aspirine.
Lorsque les chimistes ont voulu construire de tels anneaux de manière ciblée, ils ont utilisé des réactions dites de couplage, qui portent généralement le nom de leurs inventeurs :par exemple, la réaction de Diels-Alder, la réaction d'Ullmann, la cyclisation de Bergman ou le couplage de Suzuki. Maintenant, il y en a un autre qui n'a pas encore de nom. Il a été découvert par une équipe de l'Empa en collaboration avec l'Institut Max Planck pour la recherche sur les polymères à Mayence. Leurs recherches connexes ont été publiées dans Nature Synthesis et Nature Reviews Chemistry .
Tout au sec
Les chercheurs de l'Empa ont omis les liquides dans leur synthèse chimique et ont plutôt fixé les matières premières sur une surface en or dans un ultra-vide. Le matériau de départ (diisopropyl-p-terphényl) peut être observé se reposant calmement dans le microscope à effet tunnel refroidi avant que les chercheurs n'augmentent la chaleur.
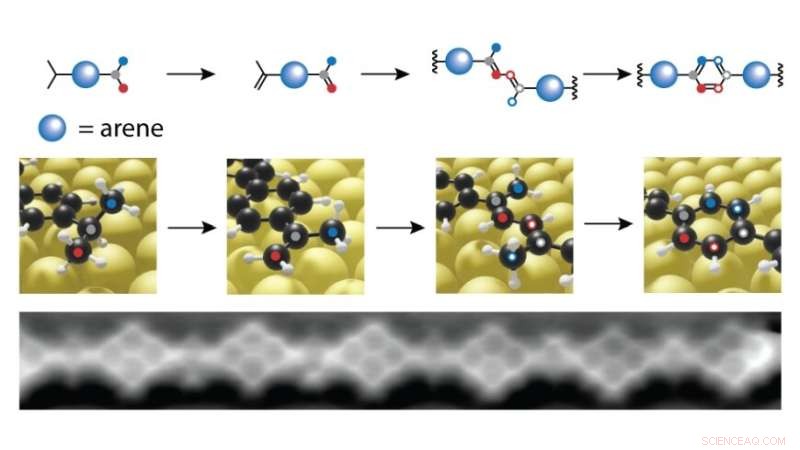
Synthèse chimique sur une surface d'or :un hydrogène est extrait des groupements isopropyles saturés. À 200 degrés Celsius, les atomes de carbone (rouge et bleu dans l'image ci-dessus) se combinent pour former un nouveau cycle benzénique. De cette façon, les blocs de construction moléculaires individuels se lient dans une chaîne polymère, comme on le voit avec le microscope à force atomique (en bas). Crédit :Empa
Montez le chauffage :mouvement sur la piste de danse
À température ambiante, rien ne se passe encore, mais à environ 200 degrés Celsius, une réaction étonnante se produit qui ne se produirait jamais dans les liquides :les deux groupes isopropyle - qui sont normalement complètement inactifs d'un point de vue chimique - se combinent pour former un cycle benzénique. La raison :en raison de la ferme "adhésion" à la surface de l'or, un atome d'hydrogène est d'abord détaché puis libéré de la molécule. Cela crée des radicaux carbonés qui attendent de nouveaux partenaires. Et il y a de nombreux partenaires à la surface de l'or. À 200 degrés Celsius, les molécules vibrent et exécutent des pirouettes rapides - il y a beaucoup de mouvement sur la piste de danse dorée. Ainsi, ce qui va ensemble se réunit bientôt.
Et encore une fois tout au ralenti
Le matchmaking sur la surface dorée présente deux avantages. Tout d'abord, il n'y a pas besoin de coercition :la réaction a lieu sans que les acides boriques ou les atomes d'halogène ne s'envolent. C'est un couplage impliquant uniquement des hydrocarbures saturés. Les matières premières sont bon marché et faciles à obtenir, et il n'y a pas de sous-produits toxiques.
Le deuxième avantage est que les chercheurs peuvent observer chaque étape de la réaction, ce qui n'est pas possible avec la chimie classique "liquide". L'équipe de l'Empa augmente simplement progressivement le chauffage de la surface de l'or. A 180 degrés Celsius, les molécules n'ont relié qu'un seul bras à leurs voisins, le second dépasse toujours librement dans la piste de danse. Si l'on refroidit maintenant la surface d'or à l'intérieur d'un microscope à effet tunnel, on peut voir et « photographier » les molécules juste avant qu'elles ne soient « mariées ». C'est exactement ce que les chercheurs ont fait. Ainsi, le mécanisme de réaction peut être suivi sous forme d'"instantanés".
Opportunités pour une "nouvelle" chimie
Les chercheurs et leurs collègues s'attendent à ce que deux types d'effets ressortent des travaux en cours. Premièrement, la "méthode de l'instantané" pourrait également convenir pour élucider des mécanismes de réaction complètement différents. L'Empa développe des instruments utilisant des impulsions laser ultracourtes dans un microscope à effet tunnel pour élucider pas à pas ces réactions chimiques. Cela pourrait fournir des informations supplémentaires sur les réactions chimiques et bientôt bousculer de nombreuses théories anciennes.
Cependant, les résultats de la recherche « du sec » pourraient également être utiles pour développer davantage la chimie « liquide ». Jusqu'à présent, la plupart des réactions documentées dans la littérature sont issues de la chimie liquide classique, et les chercheurs en sondes à balayage ont pu recréer ces expériences. À l'avenir, certaines réactions pourraient également être conçues dans le microscope à effet tunnel et ensuite transférées à la chimie liquide ou gazeuse. Mécanisme de dissociation des molécules d'oxygène sur une surface d'argent dévoilé