Résumé graphique. Crédit :Chimie de la nature (2022). DOI :10.1038/s41557-022-00937-w
À chaque instant, dans les cellules de notre corps, d'innombrables activités vitales se produisent grâce aux enzymes. Ces protéines spéciales agissent comme des catalyseurs en accélérant le rythme et en améliorant la sélectivité des réactions chimiques sans subir elles-mêmes de modifications permanentes. Au-delà de leur rôle indispensable en biologie, les enzymes sont également essentielles pour une myriade de processus dans les industries alimentaires, pharmaceutiques, agricoles et cosmétiques.
Contrairement à leur ubiquité et leur importance, les enzymes sont mal connues. En particulier, les scientifiques veulent savoir ce qui rend les sites actifs des enzymes - la région en forme de poche où se produisent les réactions chimiques accélérées - si puissants. Alors que les structures atomiques tridimensionnelles des sites actifs de nombreux enzymes ont été visualisées et cartographiées, la structure "invisible" des champs électriques à l'intérieur d'un site actif est pour la plupart inconnue. Ces champs électriques sont théorisés pour jouer un rôle important dans la formation d'un environnement précis dans les sites actifs où les molécules réagissent et passent rapidement à de nouvelles molécules.
Maintenant, une étude co-dirigée par les chercheurs de Stanford Chu Zheng et Yuezhi Mao a lancé une nouvelle sonde pour mesurer et visualiser les champs électriques à l'intérieur du site actif d'une enzyme. L'article, récemment publié dans la revue Nature Chemistry , rend compte de l'orientation des champs électriques sur le site de la réaction et pourrait aider les chercheurs à calculer les interactions chimiques clés dans les sites actifs. Ces connaissances, à leur tour, pourraient conduire à la création d'enzymes synthétiques sur mesure pour l'industrie, ainsi qu'à l'avancement considérable de la découverte et de la conception de nouveaux médicaments qui interfèrent avec ou modulent la fonction des cibles enzymatiques.
"Nous avons développé une nouvelle sonde qui peut nous donner des informations importantes sur la façon dont les champs électriques sont orientés de manière unique dans les enzymes, ce qui, selon nous, est fondamental pour l'incroyable pouvoir catalytique des enzymes", a déclaré Zheng, étudiant diplômé du laboratoire de Steven G. Boxer, le professeur de chimie Camille Dreyfus.
"Au niveau de base, nous essayons de mieux comprendre le fonctionnement des enzymes, et dans cette étude, nous ajoutons une nouvelle dimension en introduisant des orientations de champ électrique qui sont censées avoir un impact critique sur les fonctions catalytiques de l'enzyme", a déclaré Mao, un chercheur postdoctoral en chimie qui travaille dans le laboratoire de Thomas Markland, professeur agrégé de chimie à Stanford et également co-auteur principal.
Un nouvel outil puissant
Le laboratoire Boxer de Stanford a été le pionnier du concept d'interprétation de la fonctionnalité des enzymes en mesurant les interactions électrostatiques, qui sont présentes dans toutes les formes de matière et sont spécifiquement organisées en trois dimensions dans de grandes molécules biologiques.
"L'origine de l'étonnante fonctionnalité des enzymes est une question générale, et elle s'applique non seulement à la catalyse biologique, mais aussi à la catalyse chimique, qui est une entreprise énorme", a déclaré Boxer. "Environ 80 % de tous les produits chimiques sont fabriqués à l'aide de catalyseurs, mais ce qui est réellement responsable de la réduction de l'énergie libre d'activation [pour accélérer la réaction] n'est pas bien compris pour la plupart des réactions. L'étude du rôle des champs électriques dans la fonction enzymatique est très au cœur de notre travail », a déclaré Boxer, président du département de chimie de la Stanford's School of Humanities and Sciences et co-auteur principal de l'étude.
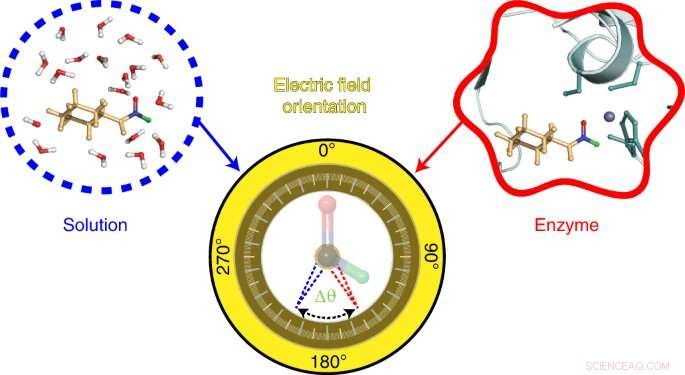
La sonde développée par l'équipe de Stanford s'appuie sur une technique, également développée dans le laboratoire Boxer, appelée spectroscopie vibrationnelle à effet Stark. Cette technique mesure les fréquences vibrationnelles dans les molécules sondes en fonction de la longueur d'onde de la lumière infrarouge absorbée par ses liaisons chimiques. Les changements de ces fréquences vibratoires révèlent des informations sur les champs électriques présents. Dans cette étude, les chercheurs ont étudié les changements dans les fréquences vibrationnelles des liaisons chimiques dans une sonde fabriquée à partir d'une molécule appelée N-cyclohexylformamide. Cette molécule agit comme un inhibiteur, se liant au site actif d'une enzyme appelée alcool déshydrogénase du foie.
To visualize the electric field in the active site of liver alcohol dehydrogenase, the researchers targeted two bonds in the N-cyclohexylformamide probe about 120 degrees away from each other. That specific angle between the two bonds allowed the researchers to gauge not only the strength, or magnitude, of the electric field, but also the field's orientation. Previous studies from the Boxer lab on other enzyme active sites had reported on the magnitude of electric fields but not on their directions.
"We call this tool a two-directional probe because with this probe we can measure the electric field in an active site in two different directions," Zheng said. "Using the probe this way, we can reconstruct and extract the orientation information about the electric field. That hasn't been done in the past."
Gathering this key measurement first required some chemical sleight of hand. One of the N-cyclohexylformamide probe's chemical bonds—between a carbon atom and a hydrogen atom—is notoriously difficult to observe in protein environments. So, the researchers swapped the hydrogen atom for the element's heavier cousin, called deuterium. The new carbon–deuterium bond proved amenable to measurement, and helped the researchers reveal the orientation of the electric field.
A precise enzymatic environment
The Stanford researchers combined their experimental data with computer simulations and quantum mechanical calculations to describe the electric field's interactions with N-cyclohexylformamide, modified with deuterium, at the active site of liver alcohol dehydrogenase. Those properties were then compared to the electric fields found in water, acetone, and other common solvents.
Notably, the researchers found the orientation of the electric field in the active site of liver alcohol dehydrogenase differs considerably from the electric field orientation in the solvents they studied. That result supports the idea that enzyme active sites feature what scientists call a preorganized electrostatic environment, or one in which the precise positioning of amino acids and the electrostatic environment they create help reduce the energy required for a chemical reaction to take place. This could be a key to enzymes' remarkable ability to catalyze reactions.
"With this study, we are helping to advance the concept of correlating the performance of enzymes with both the magnitude and orientation of the electric fields in active sites," Mao said. "What we have found is evidence that electric fields in the enzyme active sites are preorganized, and that is an important clue in solving the mystery of why enzymes have their amazing abilities."
The probe developed by the Stanford researchers could be used to investigate many other enzymes' active sites. Broadening knowledge in this way will bring scientists and engineers closer to being able to design bespoke enzymes with spectacular new characteristics.
"The ultimate goal of this research is to enable us to design enzymes that have superb catalytic performance for biomedical and industrial application," Zheng said. "We are still far from that, but we are making progress and have a better understanding now than before regarding how enzymes work." An enzyme's evolution from changing electric fields and resisting antibiotics