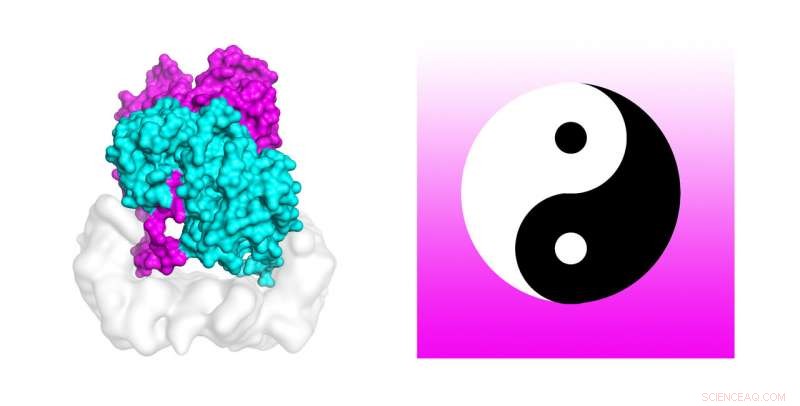
Les scientifiques utilisent de puissants superordinateurs pour découvrir le mécanisme qui active les mutations cellulaires trouvées dans environ 50 pour cent des mélanomes. Des simulations de dynamique moléculaire sur le supercalculateur Stampede2 de TACC ont testé la stabilité de la structure du complexe B-Raf:14-3-3, qui, une fois muté, est lié au cancer de la peau. Les auteurs de l'étude comparent le dimère B-Raf au symbole circulaire chinois yin-yang des opposés interconnectés joints à la queue. Crédit :Karandur et al., TACC
ça commence petit, juste un défaut de la peau. Les grains de beauté les plus courants restent ainsi :des amas inoffensifs de cellules de la peau appelées mélanocytes, qui nous donnent du pigment. Dans des cas rares, ce qui commence comme un grain de beauté peut se transformer en mélanome, le type le plus grave de cancer de la peau humaine, car il peut se propager dans tout le corps.
Les scientifiques utilisent de puissants superordinateurs pour découvrir le mécanisme qui active les mutations cellulaires trouvées dans environ 50 pour cent des mélanomes. Les scientifiques espèrent que leur étude pourra contribuer à une meilleure compréhension du cancer de la peau et à la conception de meilleurs médicaments.
En 2002, les scientifiques ont découvert un lien entre le cancer de la peau et les mutations de la kinase B-Raf (Fibrosarcome Rapidement Accéléré), une protéine qui fait partie de la chaîne de signalisation qui commence à l'extérieur de la cellule et pénètre à l'intérieur pour diriger la croissance cellulaire. Cette voie de signal, appelée voie de la kinase Ras/Raf/Mek/Erk, est important pour la recherche sur le cancer, qui cherche à comprendre la croissance cellulaire incontrôlée. Selon l'étude, environ 50 pour cent des mélanomes ont une mutation unique spécifique sur B-Raf, connu sous le nom de résidu valine 600 en glutamate (V600E).
Le B-Raf V600E est ainsi devenu une cible médicamenteuse importante, et des inhibiteurs spécifiques du mutant ont été développés dans les années suivantes. Les médicaments ont inhibé le mutant, mais quelque chose d'étrange s'est produit. Paradoxalement, calmer le mutant avait un inconvénient. Il a activé le non muté, les protéines kinases B-Raf de type sauvage, qui a de nouveau déclenché un mélanome.
"Avec ce fond, nous avons travaillé sur l'étude de la structure de cette importante protéine, B-Raf, " dit Yasushi Kondo, chercheur postdoctoral au John Kuriyan Lab de l'UC Berkeley. Kondo est co-auteur d'une étude d'octobre 2019 dans la revue Science qui a déterminé la structure du complexe de protéines qui composent B-Raf et a également découvert comment se produit l'activation paradoxale de B-Raf.
"Nous avons cherché à étudier l'état plus natif de la protéine pour comprendre comment elle est régulée dans les cellules, parce que la plupart des études se sont concentrées sur le domaine kinase isolé et sur la façon dont les médicaments se lient au domaine kinase », a déclaré Kondo.
La protéine B-Raf pleine longueur est constituée de plusieurs domaines liés par des régions désordonnées, quelque chose de trop lourd pour que les scientifiques puissent encore l'imaginer. La technique de Kondo consistait à utiliser la chimie interne pour fabriquer des fragments plus petits, puis cousez-les pour obtenir la structure complète.
"Par conséquent, nous avons obtenu une forme active du dimère B-Raf pleine longueur appelé B-Raf co-purifié avec le dimère 14-3-3, une protéine d'échafaudage liée à la queue B-Raf C-terminale phosphorylée, ", a déclaré Kondo.
Le groupe de Kondo a utilisé la cryomicroscopie électronique (cryo-EM) pour déterminer la structure du complexe B-Raf 14-3-3, essentiellement congélation cryogénique du complexe protéique, qui l'a maintenu dans un produit chimiquement actif, environnement proche de la nature. Ensuite, ils l'ont flashé avec des faisceaux d'électrons pour obtenir des milliers d'images fixes. Ils ont filtré le bruit de fond et reconstruit des cartes de densité tridimensionnelles qui montraient des détails auparavant inconnus dans la forme de la molécule. Et pour les protéines, la forme suit la fonction.
Kondo a expliqué que la structure révélait une organisation asymétrique du complexe, formé de deux ensembles de dimères symétriques intérieurement, ou des paires de molécules liées. "Nous proposons que cet arrangement inattendu permette une activation asymétrique du dimère B-Raf, qui est un mécanisme qui permet d'expliquer l'origine de l'activation paradoxale de B-Raf par des inhibiteurs à petites molécules, ", a déclaré Kondo.

Le supercalculateur Stampede2 du Texas Advanced Computing Center est une ressource allouée de l'Extreme Science and Engineering Discovery Environment (XSEDE) financé par la National Science Foundation (NSF). Crédit :TACC
Une analyse détaillée de la structure complexe asymétrique B-Raf 14-3-3 a montré une autre caractéristique structurelle inattendue, décrit comme le segment distal de la queue, DTS pour faire court, d'une molécule B-Raf. Kondo a dit que la queue de l'un est liée au site actif de l'autre, bloquant son activité en rivalisant avec la liaison à l'ATP. La molécule B-Raf bloquée est stabilisée dans la conformation active. "Nous avons interprété cette structure que cette molécule B-Raf bloquée fonctionne comme un activateur et stabilise l'autre récepteur B-Raf via l'interface dimère, ", a déclaré Kondo.
Curieusement assez, les auteurs comparent le dimère B-Raf au symbole circulaire chinois yin-yang des opposés interconnectés joints à la queue. "En regardant le sujet, il est très clair que l'on n'est pas capable de phosphoryler la molécule en aval, qui est nécessaire à la croissance cellulaire. L'autre molécule est clairement celle qui fait le travail. Dans cet ensemble de deux molécules, nous voyons clairement que l'on fait le travail de soutien, et l'autre fait le travail proprement dit. Cela ressemble vraiment au Yin et au Yang dans ce complexe B-Raf 14-3-3 que nous avons résolu, ", a déclaré Kondo.
Regards, bien que, peut être trompeur. Les scientifiques ont utilisé des simulations informatiques pour vérifier qu'ils étaient vraiment sur quelque chose. "Nous avons effectué des simulations de dynamique moléculaire de ce complexe du dimère B-Raf lié à un dimère 14-3-3 pour tester la stabilité de la conformation asymétrique, " a déclaré Deepti Karandur, co-auteur de l'étude, également chercheur postdoctoral au John Kuriyan Lab de l'UC Berkeley; elle est également boursière postdoctorale au Howard Hughes Medical Institute. "Nous ne savions pas pourquoi la conformation était asymétrique, ou quel rôle il a joué dans le maintien de l'état actif de l'enzyme, " dit Karandur.
Ils ont commencé les simulations en utilisant la structure que Kondo avait résolue par cryo-EM, avec le segment DTS allant d'une kinase au site actif de l'autre. Ensuite, ils ont exécuté une deuxième série de simulations avec le segment DTS supprimé.
"Ce que nous avons trouvé, c'est que dans le système sans segment distal de la queue, l'ensemble du complexe n'est pas stable, " a expliqué Karandur. " Les domaines de kinase se déplacent par rapport à l'échafaudage, le dimère 14-3-3. Dans l'une de nos simulations, l'état dimère du B-Raf lui-même, dont les expériences ont montré est nécessaire pour maintenir l'état actif de cette kinase, il s'est effondré, indiquant que ce segment distal de la queue, DTS, est nécessaire pour maintenir effectivement ce complexe dans cette conformation asymétrique, qui à son tour est nécessaire pour maintenir le dimère de kinase dans l'état actif de dimère asymétrique stable."
L'un des principaux résultats de l'étude a été de trouver le mécanisme d'action qui active le complexe B-Raf kinase de deux B-Raf kinases et de deux protéines d'échafaudage 14-3-3, où sur B-Raf kinase est l'activateur, et l'autre est le récepteur.
"La queue de la molécule réceptrice est à l'intérieur du site actif de l'activateur, donc l'activateur ne peut pas fonctionner comme une enzyme, " dit Kondo. " Au lieu de cela, la molécule activatrice stabilise la conformation active de la molécule réceptrice. La protéine d'échafaudage 14-3-3 facilite cet arrangement, de sorte que l'insertion de la queue n'arrive qu'à une seule molécule de kinase. Nous émettons l'hypothèse que lorsqu'il n'y a pas de liaison 14-3-3, les deux kinases peuvent être bloquées par l'insertion du DTS, mais cela doit être testé."
Les défis informatiques de l'étude impliquaient des simulations de dynamique moléculaire qui modélisaient la protéine au niveau atomique, déterminer les forces de chaque atome sur chaque autre atome pour un système d'environ 200, 000 atomes au pas de temps de deux femtosecondes.
"Pour les petits systèmes, nous pouvons voir ce qui se passe relativement rapidement, mais pour les grands systèmes comme ceux-ci, en particulier les grands systèmes biomoléculaires, ces changements se produisent sur des échelles de temps de la nanoseconde, échelles de temps de la microseconde, voire des échelles de temps en millisecondes, " dit Karandur.
Karandur et ses collègues se sont tournés vers XSEDE, l'Extreme Science and Engineering Discovery Environment, financé par la NSF, pour allouer du temps sur le supercalculateur Stampede2 du Texas Advanced Computing Center (TACC) pour faire les simulations, ainsi que le système Bridges au Pittsburgh Supercomputer Center pour étudier d'autres protéines dans la voie. les nœuds de processeur Skylake de Stampede2, en réseau avec Intel Omnipath, fait un travail rapide sur les simulations de dynamique moléculaire NAMD optimisées pour les superordinateurs.
" Stampede2 fonctionne très bien, très vite, et c'est très efficace. Nous avons généré un total d'environ 1,5 microseconde de trajectoires pour nos systèmes en environ quatre à six semaines. Tandis que, si nous l'avions exécuté sur notre propre cluster interne, cela nous aurait pris des mois ou plus, " dit Karandur.
A propos de XSEDE, Karandur a commenté :" Je pense que c'est une ressource incroyable. Je fais des simulations depuis que j'étais étudiant diplômé. XSEDE nous a permis d'accéder à des échelles de temps biologiquement pertinentes. Tout ce qui se passe dans une cellule, se produit sur des échelles de temps de la microseconde, aux échelles de temps de la milliseconde, à plus longtemps. Quand j'ai commencé, nous ne pouvions pas exécuter cette simulation sur n'importe quel système n'importe où. Je veux dire, il aurait fallu cinq ans, ou plus. Pour pouvoir le faire en quelques semaines et dire, d'accord, nous savons comprendre pourquoi cela est important afin que nous puissions maintenant commencer à comprendre réellement comment la biologie se produit, est juste incroyable, " dit Karandur.
Et il reste beaucoup à découvrir sur B-Raf. Ce n'est qu'un maillon de la chaîne du signal qui régit la croissance cellulaire et le cancer.
"La structure qui a été résolue dans cet article fait partie d'un grand système multi-domaines, " expliqua Karandur. " Nous ne savons pas à quoi ressemble cette protéine complète. Nous ne le voyons pas dans la structure. Nous ne savons pas à quoi ressemble sa dynamique, et comment toutes ces autres parties de la protéine jouent un rôle dans le maintien de l'état actif, ou le convertir de l'état inactif à l'état actif."
Elle a ajouté qu'à mesure que le système s'agrandit, les changements structurels pertinents se produisent sur des échelles de temps plus longues, et des supercalculateurs plus gros sont nécessaires pour gérer la complexité, comme le supercalculateur Frontera financé par la NSF, aussi au TACC.
"Frontera y arrive. Nous sommes très enthousiastes à ce sujet. Nous sommes en train d'obtenir une allocation sur Frontera, " dit Karandur.
Pour les non-scientifiques, cette recherche fondamentale pourrait fournir des informations menant à de meilleurs médicaments pour le cancer de la peau.
"L'activation paradoxale de la Raf kinase par ces inhibiteurs spécifiques de B-Raf transforme les cellules normales en tumeurs pendant le traitement du cancer de la peau, " a déclaré Kondo. Comprendre le mécanisme de ce phénomène nous permettra de concevoir de meilleurs médicaments. Espérons que, notre étude peut contribuer à la compréhension de cette étape. En outre, nous avons trouvé des mutations dans ce lien entre le domaine Kinase et l'élément de liaison 14-3-3 de la molécule B-Raf, qui n'a jamais été montré auparavant. Cette mutation réduit l'activité de B-Raf dans les cellules. Cela indique également que cette partie du domaine kinase peut être un point cible pour développer de nouveaux types d'inhibiteurs de B-Raf."
Karandur a déclaré:"Il y a beaucoup de dynamique qui se passe dans la cellule. Nous sommes, en grande partie à cause de XSEDE, commence seulement à être capable de regarder des choses comme ça. Aller de l'avant, la seule façon pour nous de continuer à regarder les choses est d'utiliser très, de très gros supercalculateurs, car les calculs nécessitent beaucoup de puissance de calcul. C'est vraiment excitant de pouvoir réellement voir ces choses se produire et de dire, voici comment les choses changent au niveau atomique; voici ces interactions entre ces deux atomes se forment ou se cassent, et cela se traduit par cet énorme changement au niveau mondial dans la structure globale de la protéine, et comment il interagit avec d'autres protéines, ou d'autres molécules dans la cellule. Nous sommes très enthousiastes à l'idée de savoir où cela ira à l'avenir."
L'étude, "La structure cryo-EM d'un complexe dimère B-Raf:14-3-3 révèle une asymétrie dans les sites actifs des kinases B-Raf, " a été publié le 4 octobre, 2019 dans la revue Science .