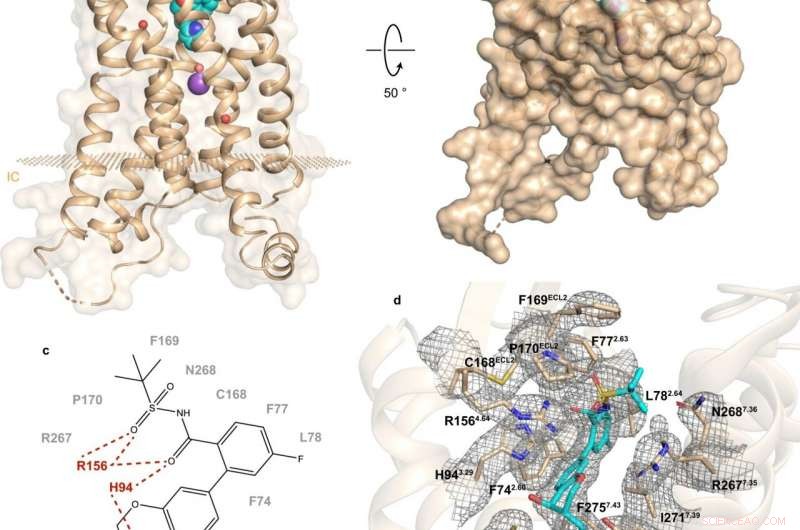
Fig. 1 :Structure et site de liaison de hBLT1. Crédit :Michaelian, N., et al. Communication Nature , https://doi.org/10.1038/s41467-021-23149-1
Des chercheurs de l'Université de Californie du Sud, Merck &Co., Skoltech, MIPT, UCLA, et l'Université de Sherbrooke ont déterminé la structure du récepteur humain du leucotriène B4 1, impliqué dans l'inflammation, infectieux, allergique, et les maladies tumorigènes. Publié dans Communication Nature , l'analyse de la structure révèle comment le récepteur reconnaît ses partenaires de liaison et interagit avec eux. Cela ouvre la voie à la conception de meilleurs médicaments qui cibleraient le récepteur pour traiter le diabète de type 2 et d'autres pathologies.
Les récepteurs sont les équipements à base de protéines que les cellules utilisent pour recevoir et transmettre des signaux. Un récepteur s'active lorsqu'il se lie à une molécule messagère appelée agoniste, après quoi il relaie le signal, qui régule certaines fonctions biologiques. Antagonistes, par contre, arrêter le récepteur lorsqu'il est lié. Les agonistes et les antagonistes sont collectivement appelés ligands.
Le récepteur humain du leucotriène B4 1, ou hBLT1, régule les processus liés à l'inflammation, tels que le recrutement des cellules T, ainsi que la prolifération et la migration des cellules musculaires lisses. Ce récepteur a été associé à des maladies, y compris l'asthme, grippe, arthrite, athérosclérose, Diabète, et cancéreux.
Depuis sa découverte en 1997, il y a eu un certain nombre de tentatives pour développer des ligands hBLT1 à utiliser comme médicaments, mais ils ont eu de nombreux effets secondaires, faible efficacité, et le corps a mis relativement longtemps à les éliminer. Une explication probable est que les ligands hBLT1 utilisés ne sont pas spécifiques de ce récepteur et s'engagent dans d'autres interactions indésirables. En savoir plus sur la structure du récepteur et sur la manière dont il se lie aux ligands peut permettre aux pharmacologues de mieux concevoir, médicaments plus sélectifs.
Une étude récente menée par une collaboration russo-américaine-canadienne met en lumière la composition et le fonctionnement de hBLT1. Vadim Cherezov, professeur de chimie à l'USC et responsable du laboratoire MIPT de biologie structurale des RCPG, a commenté :« Nous avons déterminé la structure cristalline à résolution de 2,9 angströms du récepteur hBLT1 en complexe avec un antagoniste sélectif, MK-D-046, développé par Merck &Co. Cette structure devrait aider à concevoir de manière rationnelle de meilleures thérapies pour traiter le diabète de type 2 et d'autres affections inflammatoires.
La détermination de la structure a été complétée par des études de mutagenèse dirigée et d'amarrage - une méthode expérimentale et une méthode informatique, respectivement. Selon le professeur adjoint de Skoltech Petr Popov, "cela a permis de révéler les déterminants clés des interactions intermoléculaires entre le récepteur et les ligands."
L'analyse de la structure de hBLT1 révèle comment le récepteur reconnaît et se lie aux ligands, suggérant un canal d'accès au ligand putatif enfoui dans la membrane du récepteur. Plus précisement, les résultats suggèrent les façons possibles dont le récepteur pourrait se lier à ses agonistes endogènes. C'est-à-dire, composés naturellement produits par le corps pour se lier à ce récepteur et l'activer.
En améliorant notre compréhension de la structure et du fonctionnement de hBLT1, l'étude ouvre des possibilités pour la conception de médicaments basés sur la structure.