Les atomes de ruthénium supportés sur du platine sont extrêmement actifs pour produire de l'hydrogène. Crédit :HKUST
Un groupe de chercheurs de l'Université des sciences et technologies de Hong Kong (HKUST) et de l'Université de Xiamen a révélé de nouvelles connaissances sur la façon dont les atomes de ruthénium de surface peuvent améliorer l'évolution de l'hydrogène et les activités d'oxydation du platine. Cette découverte ouvre une nouvelle voie pour la conception rationnelle de catalyseurs plus avancés pour les applications d'électrolyseurs et de piles à combustible.
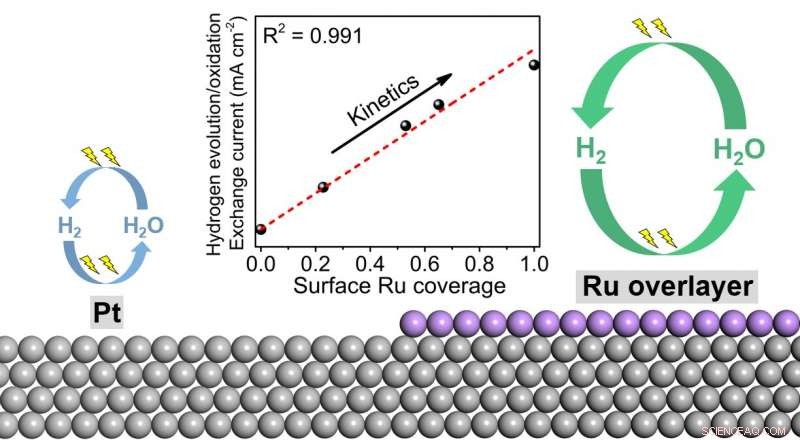
L'hydrogène est un vecteur d'énergie propre qui ne contient pas de carbone. On pense qu'il joue un rôle essentiel dans notre future société durable. L'hydrogène peut être produit à partir de l'eau via la réaction de dégagement d'hydrogène (HER) dans un électrolyseur en utilisant des énergies renouvelables, et consommé via une réaction d'oxydation de l'hydrogène (HOR) dans une pile à combustible pour produire de l'électricité. Malheureusement, ces deux réactions sont bien connues cinétiquement lentes en milieu alcalin, même sur les catalyseurs au platine les plus actifs. Les vitesses de réaction lentes limitent l'efficacité de ces deux dispositifs électrochimiques et entravent leur large adoption. Il est connu que les vitesses de réaction de HER/HOR sur le platine peuvent être améliorées par modification de surface ou alliage avec du ruthénium. Cependant, les mécanismes de cette promotion font l'objet de débats depuis des décennies. Une partie des raisons est un manque d'observation directe des comportements des atomes d'hydrogène sur les surfaces des catalyseurs.
Révéler l'énigme des hautes activités HER/HOR sur les catalyseurs bimétalliques platine-ruthénium, une équipe de recherche dirigée par le Pr Minhua Shao, Département de génie chimique et biologique et Institut de l'énergie à HKUST, a récemment appliqué la puissante spectroscopie d'absorption infrarouge à surface améliorée (SEIRAS) pour surveiller directement la force de liaison de l'intermédiaire de réaction important, atomes d'hydrogène sur diverses surfaces. Grâce à l'électrochimie combinée, spectroscopique, et des études théoriques, ils ont confirmé que les atomes de ruthénium de surface interagissant avec le platine sous la surface sont d'un ordre de grandeur plus actifs que le platine, c'est à dire., les atomes de ruthénium plutôt que de platine sont les principaux sites actifs de ce système.
"Les travaux antérieurs utilisaient principalement des techniques conventionnelles d'électrochimie et de caractérisation, qui ne peuvent pas contrôler directement le comportement d'adsorption des intermédiaires de réaction de l'hydrogène. Dans ce travail, nous utilisons la puissante spectroscopie d'absorption infrarouge à surface améliorée, qui fait partie des très rares techniques capables de "voir" directement les atomes d'hydrogène en surface, et nous fournit des informations plus directes sur la façon dont le ruthénium améliore l'activité », a déclaré le professeur Shao. « Ce travail exclut la théorie la plus répandue selon laquelle l'effet bifonctionnel sur l'interface entre le platine et le ruthénium est la cause d'une augmentation des activités, et ouvre de nouvelles directions sur la conception future de catalyseurs HER/HOR plus avancés, ce qui peut par conséquent réduire l'utilisation de métaux précieux dans les électrolyseurs à eau et les piles à combustible à hydrogène."
Ce travail fait partie du nouveau projet Collaborative Research Fund dirigé par le professeur Shao "Développement de piles à combustible à membrane alcaline haute performance et longue durée de vie, " et constitue une sous-section importante de la recherche fondamentale pour l'ensemble de ce projet. Les travaux suivants sur le développement d'électrocatalyseurs bimétalliques platine-ruthénium pratiques et à hautes performances basés sur ces résultats sont en cours.
Cette étude a été publiée récemment dans Catalyse naturelle intitulé "Le rôle du ruthénium dans l'amélioration de la cinétique de l'oxydation de l'hydrogène et des réactions d'évolution du platine".