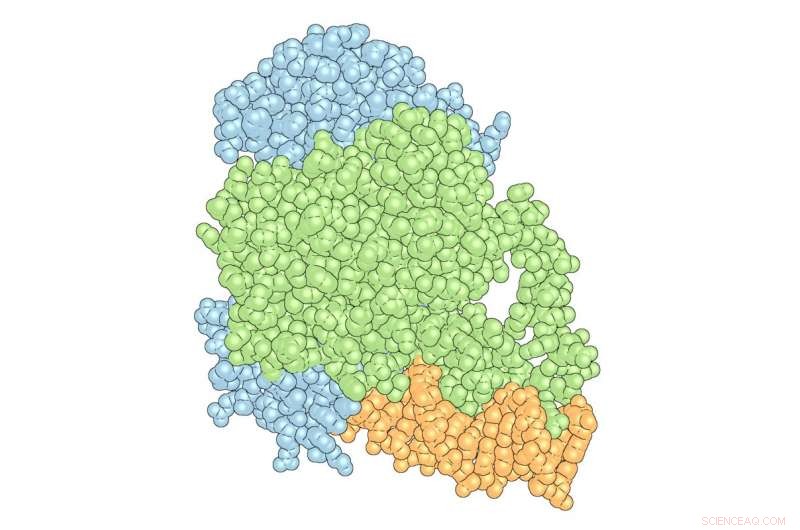
Le 'complexe' de PPARγ (vert) et RXRα (bleu) avec l'ADN (orange). Crédit : L'institut de recherche Scripps
Avec les inquiétudes accrues concernant les effets secondaires dangereux du médicament antidiabétique autrefois populaire Avandia, chercheurs du Scripps Research Institute (TSRI) à Jupiter, Floride, travaillent à comprendre comment les petites molécules, comme ceux d'Avandia, peut avoir des effets si variés dans tout le corps. Ces informations pourraient aider les chercheurs à concevoir de nouveaux médicaments avec une meilleure efficacité et moins d'effets secondaires.
Douglas Kojetin, professeur agrégé au TSRI, et son équipe ont récemment publié une étude dans Structure , montrer comment Avandia interagit avec et modifie la forme d'une combinaison de protéines, les récepteurs et l'ADN, appelés le « complexe », entraînant les effets du médicament. En plus d'aider à éclairer la conception de futurs médicaments antidiabétiques, l'étude a révélé que l'ADN joue un rôle actif dans la détermination de la structure du complexe, une découverte qui a des implications pour comprendre comment tout médicament à petite molécule affecte le corps.
Les chercheurs du laboratoire de Kojetin se concentrent sur les récepteurs nucléaires, des protéines qui peuvent interagir ou « se lier » à la fois au matériel génétique, comme l'ADN et les petites molécules, ainsi que se lier à d'autres protéines appelées protéines corégulatrices qui ont un impact sur l'expression des gènes. Avandia, par exemple, se lie à PPARγ, un récepteur nucléaire, qui se lie aux séquences d'ADN importantes dans la régulation du stockage et du métabolisme des graisses. Mais PPARγ ne travaille pas uniquement avec Avandia. Un deuxième récepteur nucléaire, RXRα, interagit avec PPARγ pour former un « hétérodimère », un complexe composé de deux protéines différentes liées ensemble qui recrute une protéine co-régulatrice appelée Steroid Receptor Coactivateur-2 (SRC-2) pour influencer l'activité de nombreux gènes différents. Comme chaque pièce se lie, le complexe change de forme, comme des morceaux d'argile humide qui se mélangent pour former un bol.
L'équipe a cherché à comprendre comment des sections spécifiques d'ADN affectent l'interaction entre le récepteur nucléaire et la protéine corégulatrice. Par exemple, ce récepteur nucléaire interagirait-il de la même manière avec la protéine corégulatrice s'il n'était pas lié à l'ADN ?
Ajout d'une couche supplémentaire de complexité, SRC-2 est une protéine intrinsèquement désordonnée - une protéine "disquette" sans structure secondaire cohérente qui s'effondre comme une nouille spaghetti en vrac. Cela signifie que les méthodes populaires que les chercheurs utilisent généralement pour comprendre la structure de la protéine, comme la cristallographie aux rayons X, qui nécessite un échantillon stable sur une disquette, ne serait pas en mesure de dire grand-chose aux scientifiques sur ce que fait cette protéine.
L'équipe de Kojetin a utilisé une combinaison de biochimie quantitative, méthodes biophysiques et structurelles de solution pour former une compréhension détaillée de ces interactions moléculaires. Chaque technique a fourni à son équipe des informations qu'ils ont utilisées pour créer une image de la façon dont toutes ces molécules interagissent.
"Aucun outil n'aurait pu nous donner la réponse. C'est vraiment la combinaison de tous ces outils qui nous a donné une image complète de ce qui se passait, " a déclaré Kojetin.
Il s'est avéré qu'il s'agissait d'un mécanisme « thermodynamique » par lequel la liaison à l'ADN provoquait le changement de forme de l'hétérodimère récepteur et, surtout, la stabilisation de ses régions souples.
L'équipe de Kojetin a montré que l'interaction de l'ADN avait un impact sur la puissance d'Avandia et sa capacité à recruter la protéine corégulatrice. Les récepteurs à eux seuls sont comme deux ballons flottant au hasard dans le vent, expliqua Kojetin. Quand il s'est lié à l'ADN, les récepteurs se stabilisent, comme si les ballons étaient attachés ensemble, facilitant l'interaction de SRC-2 avec lui.
Si les protéines s'étaient liées à une autre partie de l'ADN, le complexe peut avoir pu prendre une forme différente et exercer un effet différent, effet peut-être même dangereux, ou peut-être aucun effet du tout. Différents gènes sont exposés, ou accessibles, dans différents tissus corporels. Cela pourrait aider à expliquer comment les médicaments peuvent avoir un effet dans une certaine zone du corps et un effet différent dans d'autres zones où les sections d'ADN accessibles sont différentes.
"Le médicament ne contrôle pas l'activité dans le corps par lui-même. Lorsque le récepteur est lié à différentes séquences d'ADN, l'activité du médicament pourrait être modifiée. » Sachant cela, dit Kojetin, « va ouvrir beaucoup de possibilités. »