
Une étude menée au SLAC et à Stanford a identifié quelles paires d'atomes dans une nanoparticule de catalyseur sont les plus actives dans une réaction qui décompose un gaz d'échappement nocif dans les convertisseurs catalytiques. Les particules les plus actives contenaient la plus grande proportion d'une configuration atomique particulière - une où deux atomes, chacun entouré de sept atomes voisins, former des paires pour réaliser les étapes de réaction. Crédit :Greg Stewart/SLAC National Accelerator Laboratory
Remplacer les métaux coûteux qui décomposent les gaz d'échappement dans les convertisseurs catalytiques par des moins chers, des matériaux plus efficaces est une priorité absolue pour les scientifiques, pour des raisons à la fois économiques et environnementales. Les catalyseurs sont nécessaires pour effectuer des réactions chimiques qui ne se produiraient pas autrement, comme la conversion des gaz polluants des gaz d'échappement des automobiles en composés propres qui peuvent être rejetés dans l'environnement. Pour les améliorer, les chercheurs ont besoin d'une meilleure compréhension du fonctionnement exact de leurs catalyseurs.
Aujourd'hui, une équipe de l'Université de Stanford et du SLAC National Accelerator Laboratory du ministère de l'Énergie ont identifié exactement quelles paires d'atomes dans une nanoparticule de palladium et de platine - une combinaison couramment utilisée dans les convertisseurs - sont les plus actives pour décomposer ces gaz.
Ils ont également répondu à une question qui a intrigué les chercheurs en catalyseurs : Pourquoi les particules de catalyseur plus grosses fonctionnent-elles parfois mieux que les plus petites ? quand on s'attendrait au contraire ? La réponse a à voir avec la façon dont les particules changent de forme au cours des réactions, créer plus de ces sites très actifs.
Les résultats sont une étape importante vers l'ingénierie des catalyseurs pour de meilleures performances dans les processus industriels et les contrôles d'émissions, dit Matteo Cargnello, un professeur adjoint de génie chimique à Stanford qui a dirigé l'équipe de recherche. Leur rapport a été publié le 17 juin dans Actes de l'Académie nationale des sciences .
"Le résultat le plus excitant de ce travail a été d'identifier où se produit la réaction catalytique - sur quels sites atomiques vous pouvez effectuer cette chimie qui prend un gaz polluant et le transforme en eau inoffensive et en dioxyde de carbone, ce qui est incroyablement important et incroyablement difficile à faire, " a déclaré Cargnello. "Maintenant que nous savons où se trouvent les sites actifs, nous pouvons concevoir des catalyseurs qui fonctionnent mieux et utilisent des ingrédients moins chers."
Les catalyseurs sont nécessaires pour effectuer des réactions chimiques qui ne se produiraient pas autrement, comme la conversion des gaz polluants des gaz d'échappement des automobiles en composés propres qui peuvent être rejetés dans l'environnement. Dans le pot catalytique d'une voiture, des nanoparticules de métaux précieux comme le palladium et le platine sont fixées sur une surface céramique. Au fur et à mesure que les gaz d'émission s'écoulent, les atomes à la surface des nanoparticules s'accrochent aux molécules de gaz qui passent et les encouragent à réagir avec l'oxygène pour former de l'eau, dioxyde de carbone et autres produits chimiques moins nocifs. Une seule particule catalyse des milliards de réactions avant de s'épuiser.
Les convertisseurs catalytiques d'aujourd'hui sont conçus pour fonctionner au mieux à des températures élevées, Cargnello a dit, c'est pourquoi la plupart des émissions de gaz d'échappement nocives proviennent des véhicules qui commencent tout juste à se réchauffer. Avec plus de moteurs conçus pour fonctionner à des températures plus basses, il est urgent d'identifier de nouveaux catalyseurs plus performants à ces températures, ainsi que dans les navires et les camions qui ne passeront probablement pas à l'électricité de sitôt.
Mais qu'est-ce qui rend un catalyseur plus actif qu'un autre ? La réponse a été insaisissable.
Dans cette étude, l'équipe de recherche a examiné les nanoparticules de catalyseur constituées de platine et de palladium sous deux angles (théorie et expérience) pour voir si elles pouvaient identifier des structures atomiques spécifiques à leur surface qui contribuent à une activité plus élevée.
Particules plus rondes avec des bords déchiquetés
Côté théorie, Le scientifique du SLAC Frank Abild-Pedersen et son groupe de recherche au Centre SUNCAT pour la science des interfaces et la catalyse ont créé une nouvelle approche pour modéliser comment l'exposition aux gaz et à la vapeur pendant les réactions chimiques affecte la forme et la structure atomique d'une nanoparticule catalytique. C'est informatiquement très difficile, Abild-Pedersen a dit, et des études antérieures avaient supposé que les particules existaient dans le vide et n'avaient jamais changé.
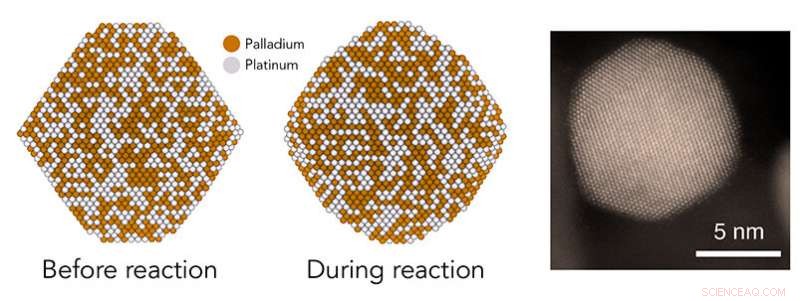
Dans une étude au SLAC et à Stanford, les théoriciens ont prédit que les nanoparticules de catalyseur faites de palladium et de platine (à gauche) deviendraient plus rondes lors de certaines réactions chimiques (au milieu), créer des caractéristiques en escalier avec des paires d'atomes qui sont des sites catalytiques particulièrement actifs. Des expériences et des images au microscope électronique comme celle de droite ont confirmé que c'est le cas, offrant une nouvelle compréhension du fonctionnement des catalyseurs. Crédit :Greg Stewart/SLAC National Accelerator Laboratory
Son groupe a créé des moyens nouveaux et plus simples de modéliser les particules dans un cadre plus complexe, environnement réaliste. Les calculs des chercheurs postdoctoraux Tej Choksi et Verena Streibel suggèrent qu'à mesure que les réactions progressent, les nanoparticules à huit faces deviennent plus rondes, et leur appartement, les surfaces en forme de facettes deviennent une série de petits pas déchiquetés.
En créant et en testant des nanoparticules de différentes tailles, chacun avec un rapport différent entre les bords dentelés et les surfaces planes, l'équipe espérait déterminer exactement quelle configuration structurelle, et même quels atomes, contribué le plus à l'activité catalytique des particules.
Un peu d'aide de l'eau
Ange Yang, un doctorat étudiant dans le groupe de Cargnello, ont fabriqué des nanoparticules de tailles contrôlées avec précision qui contenaient chacune un mélange uniformément réparti d'atomes de palladium et de platine. Pour faire ça, elle a dû développer une nouvelle méthode pour fabriquer les plus grosses particules en les ensemençant autour des plus petites. Yang a utilisé des faisceaux de rayons X de la source lumineuse de rayonnement synchrotron de Stanford du SLAC pour confirmer la composition des nanoparticules qu'elle a fabriquées avec l'aide de Simon Bare du SLAC et de son équipe.
Yang a ensuite mené des expériences où des nanoparticules de différentes tailles ont été utilisées pour catalyser une réaction qui transforme le propène, l'un des hydrocarbures les plus courants présents dans les gaz d'échappement, en dioxyde de carbone et en eau.
« L'eau a joué ici un rôle particulièrement intéressant et bénéfique, " dit-elle. " Normalement, ça empoisonne, ou se désactive, catalyseurs. Mais ici, l'exposition à l'eau a rendu les particules plus rondes et a ouvert des sites plus actifs."
Les résultats ont confirmé que les particules plus grosses étaient plus actives et qu'elles devenaient plus rondes et plus irrégulières au cours des réactions, comme les études informatiques l'avaient prédit. Les particules les plus actives contenaient la plus grande proportion d'une configuration atomique particulière - une où deux atomes, chacun entouré de sept atomes voisins, former des paires pour réaliser les étapes de réaction. Ce sont ces "7-7 paires" qui ont permis aux grosses particules de mieux fonctionner que les plus petites.
Aller de l'avant, Yang a dit, elle espère découvrir comment ensemencer des nanoparticules avec des matériaux beaucoup moins chers pour réduire leur coût et réduire l'utilisation de métaux précieux rares.
Intérêt de l'industrie
La recherche a été financée par BASF Corporation, un fabricant leader de technologie de contrôle des émissions, par l'intermédiaire de la California Research Alliance, qui coordonne la recherche entre les scientifiques de BASF et sept universités de la côte ouest, y compris Stanford.
"Cet article aborde des questions fondamentales sur les sites actifs, avec la théorie et les perspectives expérimentales se réunissant d'une manière vraiment agréable pour expliquer les phénomènes expérimentaux. Cela n'a jamais été fait auparavant, et c'est pourquoi c'est assez important, " dit Yuejin Li, un scientifique principal principal de BASF qui a participé à l'étude.
"À la fin, " il a dit, "nous voulons avoir un modèle théorique qui puisse prédire quel métal ou quelle combinaison de métaux aura une activité encore meilleure que notre état de l'art actuel."