Résumé graphique. Crédit :DOI :10.1038/s41589-021-00844-0
Malgré des avancées médicales remarquables ces dernières années, la mucoviscidose reste la maladie génétique mortelle la plus répandue. Elle est due à des mutations de la protéine CFTR qui est normalement nécessaire pour maintenir un bon équilibre hydrique dans les organes clés tels que les poumons, pancréas ou le système digestif.
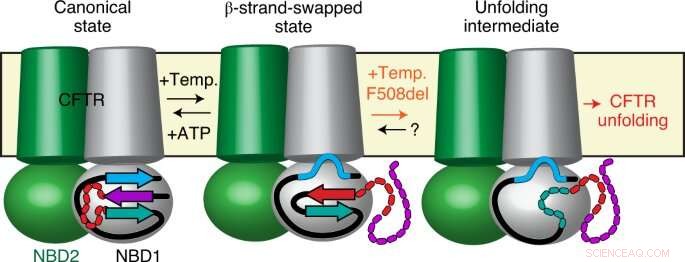
Dans la plupart des cas, la mutation causale, appelé F508del, n'implique qu'un seul des 1.480 acides aminés qui composent la protéine CFTR. Ce changement apparemment mineur entraîne de forts effets délétères sur la protéine, qui devient incapable de remplir sa fonction biologique normale, conduisant à l'apparition de la maladie. Pendant des années, les chercheurs ont tenté de comprendre comment et pourquoi une simple mutation déclenche des effets aussi importants sur la structure et la fonction des protéines, avec des conséquences dramatiques pour les patients.
En utilisant une combinaison de méthodes de pointe telles que la fluorescence à molécule unique, Cristallographie aux rayons X, échange hydrogène-deutérium et électrophysiologie monomoléculaire, chercheurs dirigés par Cédric Govaerts—Laboratoire Structure &Fonction des membranes biologiques, Faculté des Sciences, Université libre de Bruxelles - ont découvert un phénomène complètement nouveau dans le CFTR :alors que les protéines devraient adopter une conformation unique qui permet une fonction biologique unique, ils ont observé une nouvelle conformation de CFTR.
Cette structure n'avait pas été observée auparavant et démontre que CFTR n'est pas une molécule fixe mais peut alterner entre (au moins) deux conformations différentes avec des fonctions potentiellement différentes.
Étonnamment, les chercheurs ont également observé que la mutation la plus répandue, F508del, n'affecte pas les structures elles-mêmes, mais plutôt les transitions entre eux. En d'autres termes, ils proposent que les mutations causant des maladies telles que F508del ne peuvent pas, comme on le croyait auparavant, perturber la conformation finale de la protéine mais, plutôt la dynamique, spécifiquement la capacité de la protéine à échanger entre différents états au sein de la cellule.
Cette observation change notre compréhension de la biologie du CFTR et de la mucoviscidose. En outre, son phénomène pourrait s'appliquer à d'autres protéines et ainsi permettre de comprendre d'autres maladies génétiques.