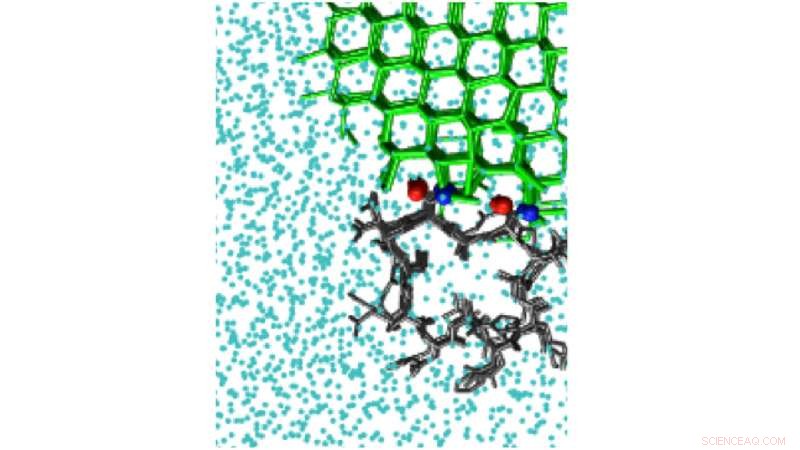
Les simulations de polarisation de la glace peuvent détecter le site de liaison à la glace de la protéine antigel hyperactive du coléoptère Tenebrio molitor, TmAFP. Crédit :Pavithra M. Naullage
Certaines molécules se lient étroitement à la surface de la glace, créant une interface incurvée qui peut arrêter la croissance de la glace. Certains insectes, les plantes, et les créatures marines contiennent des molécules de protéines de ce type qui agissent comme des agents antigel naturels, permettant aux organismes de résister à des températures glaciales.
Dans Le Journal de Physique Chimique , les scientifiques rapportent une méthode informatique pour modéliser la liaison de la glace à l'aide d'une technique de polarisation pour entraîner la formation de glace dans la simulation.
Les protéines antigel agissent en se liant à une interface existante entre la glace et l'eau liquide. La surface incurvée résultante arrête la croissance de la glace. Il existe également des molécules de nucléation de glace qui catalysent la formation de glace à partir d'eau liquide en surfusion.
Les deux phénomènes nécessitent une compréhension de la façon dont les molécules se lient à la glace. Comprendre la liaison à la glace est important pour des applications aussi diverses que la cryoconservation d'organes et la modélisation climatique, mais aucune méthode de calcul pour modéliser efficacement ce phénomène n'a existé à ce jour.
« L'avantage central de l'approche de simulation de polarisation de la glace est qu'elle identifie simultanément la surface de fixation de la glace, le visage de glace auquel il se lie, et le mode de reliure, " a déclaré l'auteur Valeria Molinero.
Les enquêteurs ont créé deux types de modèles. Un type est un modèle tout-atome qui contient tous les atomes dans les phases liquide et glacée de l'eau ainsi que dans la molécule de type antigel. L'autre type de modèle étudié est appelé modèle à gros grains, qui économise des ressources de calcul en mélangeant des atomes dans des structures plus simples.
L'étude a examiné un certain nombre de molécules qui lient la glace, y compris l'alcool polyvinylique, un inhibiteur synthétique de recristallisation de la glace, ainsi que des protéines antigel naturelles, comme celui du coléoptère Tenebrio molitor. Les protéines présentent un défi de simulation, car ils ont de très petites surfaces qui lient la glace. Cela limite la taille des cristaux de glace qu'ils peuvent lier.
Certains systèmes possèdent plus d'un endroit où la glace peut se lier. C'est le cas de la protéine antigel naturelle de la diatomée de la banquise Frailariopsis cylindrus. Pour déterminer si une protéine comme celle-ci a plus d'une surface de liaison à la glace, SCI, les enquêteurs ont mis au point une méthode qu'ils ont baptisée « cap et répétition ».
« Dans cette stratégie, nous avons d'abord effectué une simulation biaisée pour détecter un SII. Puis, nous plafonnons cet IBS pour empêcher la formation de glace dessus et effectuons une deuxième simulation de polarisation pour savoir si de la glace se forme dans d'autres sites, " dit Molinero.
Les méthodes développées dans cette étude sont très prometteuses pour un certain nombre d'applications, notamment trouver des molécules pour protéger les tissus congelés pendant le stockage, approfondir la compréhension des protéines antigel naturelles, et dans les modèles climatiques, où la nucléation de la glace dans l'atmosphère joue un rôle clé.