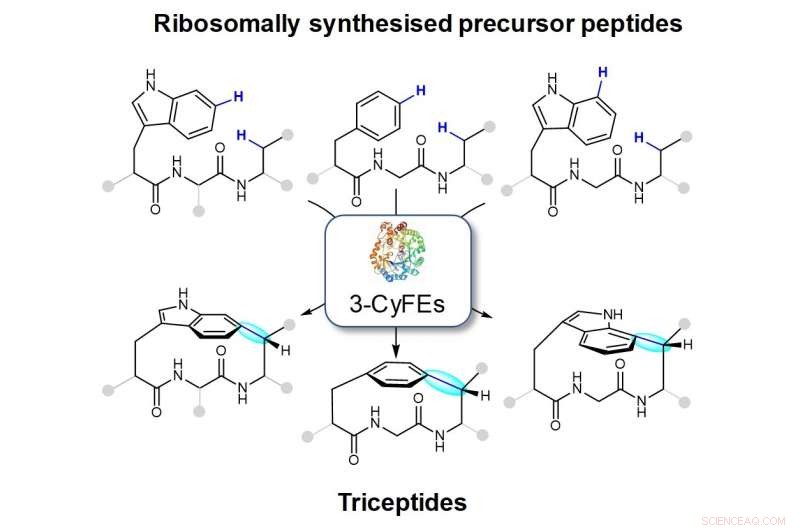
La figure montre les macrocycles créés par les enzymes formant le cyclophane à trois résidus (3-CyFEs). La nouvelle liaison est représentée en bleu et surlignée en cyan. La famille de produits naturels produits par les 3-CyFE est appelée triceptides.
Les chercheurs de NUS ont identifié des enzymes de modification post-traductionnelles dans des bactéries qui peuvent créer une nouvelle famille de peptides cycliques pour de nouvelles thérapies.
Les peptides cycliques sont une classe bien connue de molécules qui possèdent une gamme d'activités biologiques, notamment antibactériennes, propriétés immunosuppressives et anticancéreuses. L'enjeu de la création de nouveaux types de peptides cycliques réside dans la découverte de nouvelles réactions catalytiques par synthèse chimique ou en utilisant des enzymes. Une stratégie pour y parvenir implique la formation de liaisons carbone-carbone (C-C). Cependant, Les réactions de formation de liaisons C-C au niveau des liaisons carbone-hydrogène (C-H) non activées sont difficiles car ces positions sont inertes, et la sélectivité n'est pas facile à contrôler. Surmonter ces barrières permettra la création d'une nouvelle gamme de peptides cycliques de manière efficace et prévisible.
L'équipe de recherche dirigée par le Pr Brandon Morinaka du Département de Pharmacie, NUS a trouvé des réactions catalysées par une suite d'enzymes de modification post-traductionnelles provenant de diverses bactéries qui peuvent potentiellement être utilisées pour développer des molécules médicamenteuses importantes. Ces enzymes peuvent catalyser la formation d'un C(aryl)-C( sp 3 ) liaison entre les chaînes latérales de deux acides aminés. Cet arrangement moléculaire est la caractéristique déterminante d'une classe de produits naturels appelés triceptides (trois résidus dans les peptides cyclophane) (voir figure). La réaction de cyclisation entraîne la formation de cyclophanes peptidiques tendus. Bien que ces enzymes soient codées dans plusieurs centaines de génomes bactériens, leur fonction et leurs produits finaux sont restés largement inconnus.
Ces enzymes offrent une nouvelle stratégie pour la modification des peptides et peuvent être appliquées pour générer des peptides thérapeutiques qui présentent une liaison unique aux cibles moléculaires. La cyclisation des peptides est une stratégie générale utilisée dans la nature et la chimie de synthèse pour empêcher la dégradation par les enzymes digestives. La prévention de la dégradation est un attribut essentiel nécessaire pour que les médicaments atteignent leur cible et représente un obstacle à l'utilisation de peptides comme médicaments.
Ces enzymes sont capables d'installer les anneaux dans une variété de modèles avec différents acides aminés. Cela signifie que la gamme de produits est potentiellement large et peut être appliquée à diverses cibles dans la découverte de médicaments. Diverses bactéries provenant d'une gamme de microbiomes ont été trouvées pour coder les enzymes formant le cyclophane. La diversité des produits suggère que les cyclophanes peptidiques sont plus répandus qu'on ne le savait auparavant et peuvent conférer une utilisation ou une fonction générale à cette classe de produits naturels.
L'équipe prévoit de produire des produits naturels supplémentaires à base de triceptides et de comprendre le mécanisme enzymatique. Leurs objectifs à long terme sont de générer une gamme diversifiée de produits de cyclophane peptidique qui peuvent être utilisés comme point de départ pour cibler les maladies d'intérêt.
Le professeur Morinaka a dit, "Les enzymes de formation de cyclophane post-traductionnelles offrent une nouvelle méthode pour créer divers peptides cycliques qui offrent de nouvelles opportunités dans l'ingénierie peptidique et la découverte de médicaments."