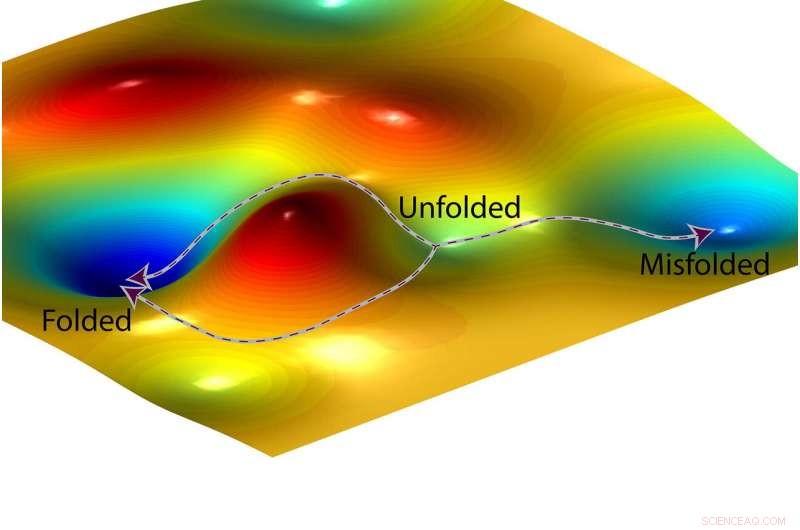
Représentation d'un artiste d'un paysage d'énergie libre et de deux chemins possibles qu'une protéine pourrait suivre (à gauche) pour se plier correctement et un troisième chemin (à droite) qui mène à un état mal replié. Crédit :O. Igoshin/Rice University
Des chercheurs de l'Université Rice ont découvert une symétrie cachée dans les équations cinétiques chimiques que les scientifiques utilisent depuis longtemps pour modéliser et étudier de nombreux processus chimiques essentiels à la vie.
La découverte a des implications pour la conception de médicaments, génétique et la recherche biomédicale et est décrite dans une étude publiée ce mois-ci dans le Actes de l'Académie nationale des sciences . Pour illustrer les ramifications biologiques, les co-auteurs de l'étude Oleg Igoshin, Anatoly Kolomeisky et Joel Mallory du Rice's Center for Theoretical Biological Physics (CTBP) ont utilisé trois exemples de grande envergure :le repliement des protéines, catalyse enzymatique et efficacité des protéines motrices.
Dans chaque cas, les chercheurs ont démontré qu'un simple rapport mathématique montre que la probabilité d'erreurs est contrôlée par la cinétique plutôt que par la thermodynamique.
"Il pourrait s'agir d'une protéine se repliant dans la conformation correcte par rapport à la conformation incorrecte, une enzyme incorporant le bon ou le mauvais acide aminé dans la chaîne polypeptidique, ou une protéine motrice reculant par erreur au lieu d'avancer, " dit Igochine, un chercheur du CTBP et professeur de bio-ingénierie à Rice. "Toutes ces propriétés peuvent être exprimées sous la forme d'un rapport de deux flux en régime permanent, et nous avons constaté que les propriétés biologiques exprimées en ces termes sont sous contrôle cinétique. »
L'exemple de repliement des protéines illustre les implications pour la conception de médicaments. Toutes les protéines se replient en une forme caractéristique, et une fraction mal pliée dans la mauvaise forme. Le mauvais repliement des protéines a été impliqué dans certains troubles et maladies génétiques héréditaires, et les fabricants de médicaments sont intéressés à fabriquer des médicaments qui peuvent réduire les risques de mauvais repliement des protéines.
Avant qu'il ne se plie, une protéine a de l'énergie, comme une balle assise au sommet d'une colline. Le pliage est la descente depuis ce point de départ à haute énergie jusqu'à l'endroit où la balle s'arrête de rouler. Les chimistes utilisent souvent une aide visuelle appelée « paysage d'énergie libre » pour représenter les niveaux d'énergie dans les réactions chimiques. Le paysage ressemble à une chaîne de montagnes avec des pics et des vallées, et la descente depuis le point de départ déplié d'une protéine jusqu'à son point d'arrivée complètement replié peut ressembler à une route de montagne qui serpente à travers une série de vallées. Même si une ville le long de la route est plus basse en altitude, un voyageur peut avoir à gravir des collines pour se rendre d'une vallée à l'autre en descendant.
"Nous avons montré que ce sont les barrières, les points hauts entre les vallées, qui déterminent ces ratios, " dit Igoshin. " Les profondeurs des vallées n'ont pas d'importance.
"Si vous voulez obtenir un médicament qui aidera une protéine à se replier correctement, par exemple, notre prédiction est que le médicament doit être capable de réduire une barrière le long de la voie de repliement, " dit-il. " Si cela n'affecte que les vallées, disons en améliorant la stabilité de certaines conformations intermédiaires le long de la voie de pliage, cela ne changera pas le ratio de fois où la protéine se replie correctement par rapport à mal."
Igoshin a déclaré que le travail découlait d'une étude de 2017 où il, Kolomeisky et l'ancien chercheur postdoctoral du CTBP Kinshuk Banerjee ont montré que la précision de la catalyse enzymatique était contrôlée cinétiquement. Igoshin a décrit la découverte comme une "sorte de symétrie sous-jacente des équations".
"Si vous regardez les rapports de flux, vous obtenez cette annulation intéressante, et tous les termes qui ont à voir avec ces valeurs s'annulent, et vous obtenez l'invariance, " dit-il. " Quand nous avons obtenu ce résultat pour la première fois, cela nous a semblé contre-intuitif. Puis, nous ne savions pas si c'était une coïncidence, car dans l'article précédent, nous l'avons montré pour seulement deux schémas cinétiques particuliers. Maintenant, le travail de Joel a montré qu'il peut être généralisé à cette large gamme de systèmes. »
Igoshin a déclaré que la symétrie "n'était pas si difficile à prouver, mais personne ne l'avait remarqué avant."
"Je pense que c'est un résultat physique très intéressant qui a de grandes implications en biologie, ", a-t-il déclaré. "Cela pourrait aider à définir les limites de ce qui est possible en termes de contrôle et d'optimisation des propriétés au niveau du système dans de nombreux processus biologiques."