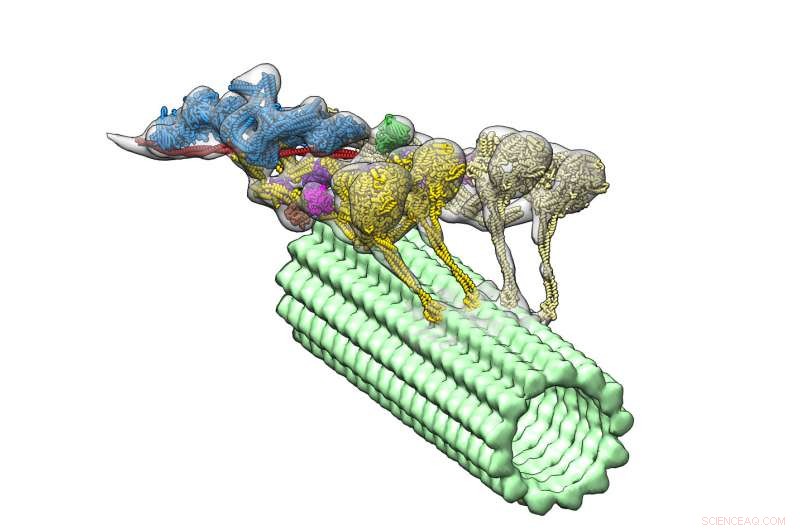
Le complexe dynéine-dynactine (multicolore) entraîne un microtubule (vert). Les quatre domaines moteurs sont représentés en jaune. Dynactine (bleu) fournit l'échafaudage pour maintenir les deux dynéines ensemble. Crédit :Danielle Grotjohn, Laboratoire d'atterrisseur
Sur l'autoroute cellulaire, des protéines motrices appelées dynéines dominent la route. Les dyneines " marchent " le long de structures appelées microtubules pour délivrer une cargaison cellulaire, comme les molécules de signalisation et les organites, aux différentes parties d'une cellule. Sans dynéine au travail, les cellules ne peuvent pas se diviser et les gens peuvent développer des maladies neurologiques.
Maintenant une nouvelle étude, qui paraît dans le journal Nature Biologie structurale et moléculaire , fournit la première visualisation tridimensionnelle (3D) du complexe dynéine-dynactine lié aux microtubules. Les responsables de l'étude du Scripps Research Institute (TSRI) rapportent qu'une protéine appelée dynactine relie deux dynéines ensemble, comme un joug enfermant ensemble une paire de chevaux de trait.
"Si vous voulez qu'un attelage de chevaux se déplace dans une direction, il faut les aligner, " dit Gabriel C. Lander, Doctorat, professeur agrégé TSRI et auteur principal de l'étude. "C'est exactement ce que la dynactine fait aux molécules de dynéine."
Comprendre comment le complexe dynéine-dynactine est assemblé et organisé fournit une base essentielle pour expliquer les causes sous-jacentes de plusieurs maladies neurodégénératives liées à la dynéine telles que l'amyotrophie spinale (SMA) et la maladie de Charcot-Marie-Tooth (CMT).
Les chercheurs savaient que la dynactine est nécessaire à la dynéine pour déplacer la cargaison, mais ils ont eu du mal à obtenir une image complète de la façon dont les différentes parties du complexe fonctionnaient ensemble.
"Nous savions que la dynéine ne devient active que lorsqu'elle se lie à un partenaire appelé dynactine. Le problème était que, historiquement, il était difficile de résoudre cette structure car elle est très flexible et dynamique, " explique Danielle Grotjahn, un étudiant diplômé TSRI et co-premier auteur de l'étude. "Nous avions besoin de visualiser ces complexes dynéine-dynactine pour comprendre fondamentalement comment cela fonctionne pour transporter des molécules."
Pour la nouvelle étude, les chercheurs ont utilisé une technique d'imagerie appelée tomographie cryoélectronique, qui est similaire à l'acquisition d'une tomodensitométrie d'une protéine, réaliser une reconstruction 3D, ou tomogramme. Pour augmenter la résolution et la clarté de ces tomogrammes, les chercheurs ont utilisé des algorithmes informatiques avancés pour faire la moyenne de nombreux complexes protéiques individuels.
Dans ce cas, cependant, les méthodes de traitement actuelles n'étaient pas en mesure de produire une structure 3D interprétable du complexe dynéine-dynactine extrêmement flexible.
Grotjahn savait que les informations nécessaires étaient cachées dans les tomogrammes, elle a donc développé une nouvelle stratégie pour identifier des composants spécifiques du complexe dynéine-dynactine. Cette approche a aidé à guider le logiciel de traitement d'image pour reconstruire l'ensemble du complexe moteur lié aux microtubules.
"Danielle faisait le premier grand pas pour les algorithmes de calcul, " dit Lander.
Avec leur nouveau, structure détaillée, les chercheurs ont remarqué une caractéristique surprenante :le complexe contient deux molécules de dynéine là où ils s'attendaient à n'en voir qu'une. Cela signifie que chaque dynéine a deux domaines moteurs, le complexe dynéine-dynactine a quatre domaines moteurs au total.
"Cette découverte était totalement inattendue, et changera la façon dont ce complexe moteur est représenté dans les manuels de biologie cellulaire et de biochimie, " dit Saikat Chowdhury, Doctorat, un associé de recherche TSRI et co-premier auteur de l'étude.
"Il y avait eu des années d'expériences biophysiques et d'expériences biochimiques, et on a toujours supposé qu'il n'y avait qu'une seule molécule de dynéine, ", ajoute Lander.
Les chercheurs ont également pu voir où s'inscrivait la dynactine. Ils ont découvert que la molécule fournit un échafaudage stable, réunir l'équipe des domaines moteurs et activer leur capacité à se déplacer le long des microtubules. Cette découverte permet d'expliquer comment la dynéine peut transporter de grandes charges, comme des organites beaucoup plus gros qu'eux, sur de longues distances dans un environnement cellulaire surpeuplé.
L'approche de traitement d'image utilisée dans cette étude a le potentiel d'être extrêmement utile pour résoudre les structures d'autres grands, protéines souples.
« Nous sommes maintenant capables de dépasser les modèles de dessins animés et de visualiser les détails fins de nombreux complexes macromoléculaires dynamiques, " dit Grotjahn. " Alors que nous en apprenons davantage sur l'organisation et l'architecture 3D de ces machines moléculaires, nous serons mieux équipés pour comprendre comment ils fonctionnent mal dans la maladie."
Auteurs supplémentaires de l'étude, "La tomographie cryoélectronique révèle que la dynactine recrute une équipe de dynéines pour la motilité progressive, " étaient Yiru Xu du Scripps Research Institute; Richard J. McKenney de l'Université de Californie, Davis; et Trina A. Schroer de l'Université Johns Hopkins.