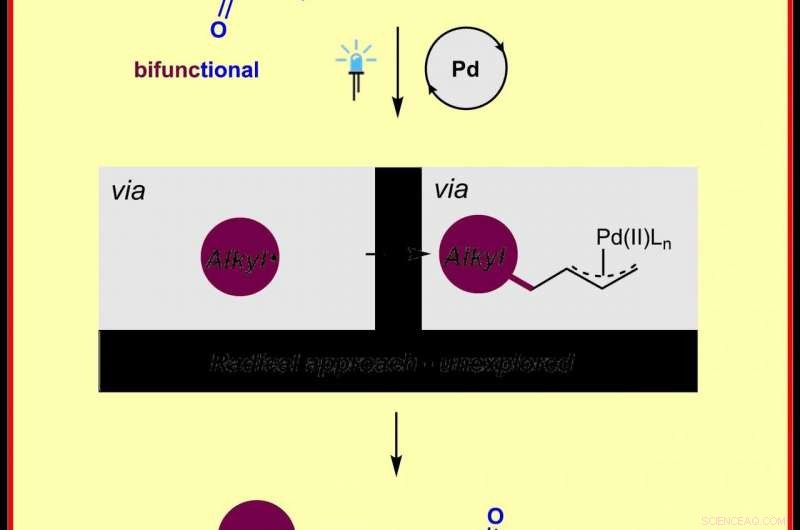
Illustration chimique de la nouvelle méthode de production de complexes π-allylpalladium par chimie radicalaire Crédit :Frank Glorius
Dans la production de composés, les chimistes ont pour objectif fondamental de trouver les stratégies les plus sélectives et d'éviter les déchets. Les percées dans ce domaine servent, entre autres, stimuler l'innovation industrielle et le développement de médicaments. Dans ce contexte, les réactions de substitution allylique utilisant des catalyseurs à base de métaux dits de transition ont déjà permis des avancées scientifiques significatives. Dans une molécule les catalyseurs provoquent le remplacement d'un groupe fonctionnel par un autre groupe en position allylique, c'est-à-dire à proximité directe d'une double liaison carbone-carbone.
En particulier, la fonctionnalisation dite allylique au moyen d'un catalyseur à base de palladium, métal de transition, est devenue une stratégie bien établie pour construire des liaisons carbone-carbone ou carbone-hétéroatome, et son utilité a été démontrée dans la synthèse de produits naturels, découverte de médicaments et science des matériaux. Néanmoins, il y a encore des défis considérables dans la pratique, notamment en ce qui concerne la durabilité des substances et leur capacité à subir des réactions chimiques.
Aujourd'hui, une équipe de chercheurs dirigée par le professeur Frank Glorius de l'Université de Münster (Allemagne) a développé une nouvelle approche de la fonctionnalisation des allyles et généré des complexes π-allylpalladium en utilisant la chimie radicalaire. L'étude a été publiée dans la revue Catalyse naturelle .
Plusieurs méthodes avaient déjà été développées pour générer des complexes π-allylpalladium par le biais de mécanismes ioniques; cependant, ces procédés nécessitent généralement soit des matières premières préfonctionnalisées, soit des oxydants stoechiométriques, ce qui limite naturellement leur portée. « C'est la première fois que l'on réalise les complexes π-allylpalladium en utilisant une stratégie radicale. Nous espérons que cette stratégie radicale sera rapidement adoptée par la communauté synthétique et utilisée comme méthode complémentaire pour permettre un certain nombre d'autres réactions connexes, " déclare le professeur Frank Glorius.
Voici comment fonctionne la nouvelle méthode :un catalyseur au palladium disponible dans le commerce est photoexcité par la lumière visible, la fusion d'esters de N-hydroxyphtalimide dérivés d'acides carboxyliques aliphatiques abondants et bon marché et de butadiène comme matière première, permettant la génération de complexes π-allylpalladium. Cela conduit à un soi-disant 1, 4-aminoalkylation des diènes, que les scientifiques ont pu montrer à travers plus de 60 exemples. De plus, ils pourraient démontrer l'utilité de cette stratégie dans les réactions en cascade radicale et dans la modification de médicaments et de produits naturels.
« Il s'agit d'une innovation dans la chimie du palladium – nous avons enseigné de nouvelles astuces à cet ancien catalyseur de métal de transition. De plus, des esters de N-hydroxyphtalimide facilement disponibles ont été utilisés comme réactifs bifonctionnels, tuant deux oiseaux avec une pierre, " dit le Dr Huan-Ming Huang, premier auteur de l'étude.