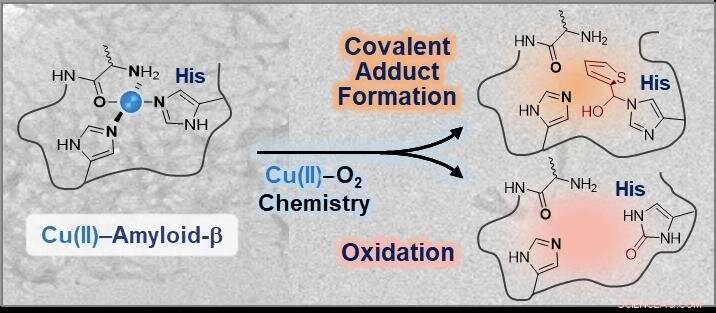
Modifications chimiques de la sphère de coordination dans Cu(II)-amyloïde-β utilisant la chimie du cuivre-O2. Crédit :KAIST
Il est devenu évident récemment que les interactions entre le cuivre et l'amyloïde-β ont un impact neurotoxique sur le cerveau des patients atteints de la maladie d'Alzheimer. Les chercheurs de KAIST ont signalé une nouvelle stratégie pour modifier la neurotoxicité dans la maladie d'Alzheimer en utilisant un réactif chimique conçu de manière rationnelle.
Cette stratégie, développé par le professeur Mi Hee Lim du département de chimie, peut modifier la sphère de coordination du cuivre lié à l'amyloïde-β, inhibant efficacement la liaison du cuivre à l'amyloïde-β et modifiant son agrégation et sa toxicité. Leur étude a été présentée dans PNAS le mois dernier.
Les chercheurs ont développé une petite molécule capable d'interagir directement avec la sphère de coordination des complexes cuivre-amyloïde-β suivie de modifications via soit une conjugaison covalente, oxydation, ou les deux dans des conditions aérobies. L'équipe de recherche a simplement utilisé la chimie cuivre-dioxygène pour concevoir un réactif chimique.
Répondre à la manière dont les modifications peptidiques par une petite molécule se produisent reste très difficile. Le système comprend des métaux de transition et des protéines amyloïdogènes et est assez hétérogène, car ils sont continuellement modifiés. Il est essentiel de vérifier soigneusement les multiples variables telles que la présence de dioxygène et le type d'ions de métaux de transition et de protéines amyloïdogènes afin d'identifier les mécanismes sous-jacents et la spécificité de la cible du réactif chimique.
L'équipe de recherche a utilisé diverses méthodes biophysiques et biochimiques pour déterminer les mécanismes de modifications de la sphère de coordination des complexes cuivre-Aβ. Parmi eux, les modifications peptidiques ont été principalement analysées par spectrométrie de masse à ionisation électrospray.
La spectrométrie de masse (MS) a été appliquée pour vérifier de telles modifications peptidiques en calculant le changement de masse exacte. L'équipe de recherche a également effectué une dissociation induite par collision (CID) de l'ion cible détecté par MS pour déterminer quel résidu d'acide aminé est spécifiquement modifié. Le CID fragmente la liaison amide située entre les résidus d'acides aminés. Cette analyse fragmentaire nous permet d'identifier les sites spécifiques de modifications peptidiques.

Le professeur Lim (à gauche) et le doctorant Han. Crédit : Institut coréen avancé des sciences et de la technologie (KAIST)
Les complexes de cuivre et d'amyloïde-β représentent une connexion pathologique entre les ions métalliques et l'amyloïde-β dans la maladie d'Alzheimer. Des découvertes récentes indiquent que le cuivre et l'amyloïde-β peuvent contribuer directement à la neurodégénérescence en produisant des oligomères toxiques de l'amyloïde-β et des espèces réactives de l'oxygène.
Le professeur Lim a dit, "Cette étude illustre la première preuve expérimentale que le 14e résidu d'histidine dans les complexes cuivre-amyloïde-β peut être spécifiquement modifié par conjugaison covalente, oxydation, ou les deux. Compte tenu des implications neurotoxiques des interactions entre le cuivre et l'amyloïde-β, de telles modifications au niveau de la sphère de coordination du cuivre dans l'amyloïde-β pourraient effectivement altérer ses propriétés et sa toxicité."
"Cette étude multidisciplinaire mettant l'accent sur les approches, réactivités, et mécanismes se réjouit d'ouvrir une nouvelle voie pour développer des candidats de maladies anti-neurodégénératives, " a-t-elle ajouté. La Fondation nationale pour la recherche de Corée a financé cette recherche.