
Conjugué aux phages, les nanotiges d'or trouvent leur cible :une paroi cellulaire bactérienne. Crédit :Université de Californie - Santa Barbara
La lutte contre les agents pathogènes résistants aux médicaments reste intense. Alors que le rapport 2019 des Centers for Disease Control (CDC) sur les "plus grandes menaces" révèle une diminution globale des décès liés aux microbes résistants aux médicaments par rapport à son rapport précédent (2013), l'agence avertit également que de nouvelles formes d'agents pathogènes résistants aux médicaments sont toujours émergent.
Pendant ce temps, les options de traitement des infections par ces germes diminuent, confirmant les inquiétudes des médecins et des scientifiques quant à la fin de l'ère des antibiotiques.
"Nous savions que cela allait être un problème dès le début, ", a déclaré Irene Chen, professeur de chimie et de biochimie à l'UC Santa Barbara. "En gros, dès que la pénicilline a été découverte, quelques années plus tard, il a été signalé qu'il y avait un organisme résistant. » Grâce à des facteurs tels que le transfert horizontal de gènes et la reproduction rapide, des organismes tels que les bactéries Gram-négatives sont capables d'évoluer plus rapidement que nous ne pouvons produire des antibiotiques pour les contrôler.
Chen et son groupe de recherche cherchent donc des alternatives aux antibiotiques, dans un effort croissant pour éviter la marée d'infections bactériennes incurables. Dans leur travail, le groupe s'est tourné vers les bactériophages, un groupe naturel de virus qui colonisent les bactéries.
"C'est leur fonction naturelle, vraiment, pour se développer et tuer les bactéries, " dit Chen, auteur d'un article paru dans le Actes de l'Académie nationale des sciences . En tirant parti de la capacité des bactériophages à se concentrer sur des bactéries spécifiques sans endommager le reste du microbiome, les chercheurs ont pu utiliser une combinaison de nanotiges d'or et de lumière proche infrarouge pour détruire même les bactéries multirésistantes sans antibiotiques.
La phagothérapie n'est pas nouvelle, dit Chen. En réalité, il est utilisé dans l'ex-Union soviétique et en Europe depuis environ un siècle, bien qu'ils soient largement considérés comme des alternatives de dernier recours aux antibiotiques. Parmi les problèmes non résolus de la thérapie par les phages, il y a la caractérisation incomplète de la biologie des phages, une biologie qui pourrait permettre des conséquences inattendues dues à l'évolution et à la reproduction rapides des phages, ainsi que les toxines potentielles que les virus peuvent transporter. Un autre problème est l'aspect tout ou rien de la phagothérapie, elle a ajouté.
"Il est difficile d'analyser l'effet d'un traitement phagique, " dit-elle. " Vous pourriez le voir fonctionner complètement ou vous pourriez le voir échouer complètement, mais vous n'avez pas le type de réponse à la dose que vous souhaitez."
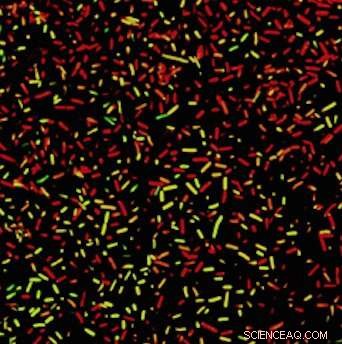
Bactéries sous le feu :Les bactéries vertes sont vivantes, tandis que les rouges sont morts. Crédit :Université de Californie - Santa Barbara
Pour surmonter ces défis, le laboratoire Chen a développé une méthode de phagothérapie contrôlée.
"Ce que nous avons fait était de conjuguer les phages à des nanotiges d'or, », a-t-elle expliqué. Ces « phanorods » ont été appliqués à des bactéries sur des cultures in vitro de cellules de mammifères puis exposées à la lumière proche infrarouge.
"Lorsque ces nanotiges sont photo-excitées, ils traduisent l'énergie de la lumière en chaleur, " Chen a dit, "et cela crée des températures locales très élevées."
La chaleur suffit à tuer les bactéries, et il tue aussi les phages, empêchant toute évolution ultérieure indésirable. Le résultat est un missile guidé de phagothérapie ciblée qui permet également de contrôler la posologie. Le laboratoire a réussi à détruire E. coli, P. aeruginosa et V. cholerae—agents pathogènes humains qui provoquent des symptômes aigus s'ils ne sont pas contrôlés. Ils ont également réussi à détruire X. campestris, une bactérie qui cause la pourriture des plantes.
En collaboration avec Beth Pruitt, ingénieur en mécanique de l'UC Santa Barbara, le laboratoire a déterminé que même si la chaleur détruisait avec succès les bactéries et les phages, plus de 80% de la culture de cellules de mammifères sous le biofilm bactérien a survécu.
"Cette question de savoir si cela endommage les tissus des mammifères est très importante, " a déclaré Chen. " Les travaux en nanotechnologie et en nanomédecine traitant des infections bactériennes indiquent que lorsqu'ils ne sont pas ciblés, cela pèse vraiment sur les tissus environnants."
Le laboratoire prévoit d'étudier d'autres phages possibles pour contrer d'autres bactéries, éventuellement concevoir une méthode photothermique qui pourrait traiter de multiples infections bactériennes.