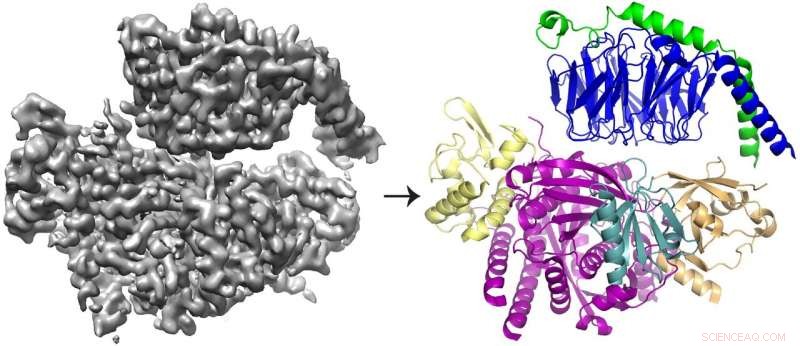
La reconstruction cryo-EM 3D (à gauche) de la protéine P-Rex1 liée à Gβγ et le modèle protéique (à droite) montrant que Gβγ (en haut ; bleu et vert) se lie à un compact, surface multidomaine sur P-Rex1 (en bas ; jaune, magenta, sarcelle et or). Crédit :Jennifer Cash, Institut des sciences de la vie U-M.
Lorsque les cellules de notre corps ont besoin de bouger pour attaquer une infection ou guérir une plaie, par exemple, les protéines cellulaires envoient et reçoivent une cascade de signaux qui dirigent les cellules au bon endroit au bon moment. C'est un processus que les cellules cancéreuses peuvent détourner pour se propager à de nouveaux tissus et organes.
Maintenant, une équipe de chercheurs dirigée par l'Institut des sciences de la vie de l'Université du Michigan a mis en lumière un facteur clé de ce processus. Les résultats, devrait être publié le 16 octobre dans Avancées scientifiques , offrent des informations importantes sur la migration cellulaire non seulement dans des conditions de santé normales, mais aussi au sein, prostate et d'autres types de cancers.
Les chercheurs ont spécifiquement sondé une protéine appelée P-Rex1 (phosphatidylinositol 3, 4, Echangeur Rac 5-triphosphate-dépendant 1), qui est activé lorsqu'il se lie à une autre protéine, Gbg. Malgré la découverte du P-Rex1 il y a plus de 15 ans, précisément comment les deux protéines interagissent et comment cette interaction conduit au mouvement cellulaire est restée mal comprise.
En utilisant une combinaison de techniques de biologie structurale et de biochimie, les chercheurs ont révélé la structure du P-Rex1 lié au Gbg, fournissant un aperçu de la façon dont ce processus d'activation complexe se déroule.
"Connaître la structure de ce complexe protéique fournit des détails mécanistiques qui nous permettent de comprendre comment il est régulé, " a déclaré Jennifer Cash, Chercheur LSI et auteur principal de l'étude. "Et quand on comprend comment c'est régulé, nous pouvons commencer à réfléchir à la manière de modifier cette régulation et d'inhiber la signalisation P-Rex1 dans les cancers."
L'équipe a découvert que le Gbg se lie à une surface étendue sur P-Rex1 composée de plusieurs domaines protéiques différents. Des études antérieures ont proposé des arguments contradictoires sur le ou les domaines liés au Gbg. Mais cette dernière étude a pu résoudre le conflit en prenant une vue plus large de la protéine, en utilisant des technologies plus récentes.
« Nous voulions examiner l'enzyme dans son ensemble - et pour ce faire, nous avions vraiment besoin de passer à la cryo-EM, " a déclaré John Tesmer, professeur de sciences biologiques à l'Université Purdue et l'un des auteurs principaux de l'étude.
Cryo-EM, ou cryo-microscopie électronique, permet aux chercheurs d'étudier des protéines qui ne peuvent pas être visualisées à l'aide d'autres techniques de biologie structurale, telles que le complexe, structure entrelacée de P-Rex1. Le processus consiste à congeler des protéines dans une fine couche d'eau, puis à utiliser des électrons pour capturer des images de leur forme. Des centaines de milliers d'images sont ensuite moyennées pour créer une structure 3D.
Au-delà de clarifier comment Gbg se lie et active P-Rex1, ces nouvelles découvertes constituent une pierre de touche importante dans le développement de la cryo-EM, dit Michael Cianfrocco, Professeur assistant LSI et auteur principal de l'étude.
La majorité des structures déterminées avec cryo-EM sont plus grandes, molécules symétriques. Les résultats pour P-Rex1, en revanche, représentent une structure à haute résolution de la plus petite protéine asymétrique réalisée par cryo-EM à ce jour. Par ailleurs, un grand domaine dans P-Rex1 a une structure ou un repli qui n'avait pas été identifié auparavant dans aucune autre protéine de mammifère, obligeant l'équipe à le construire pièce par pièce, une tâche difficile avec les données cryo-EM.
"La cryo-EM est encore un domaine relativement nouveau, et les gens sont vraiment intéressés à savoir jusqu'où ses limites peuvent être poussées, " dit Cianfrocco, qui est également professeur adjoint de chimie biologique à la faculté de médecine U-M.
Les articles de Science Advances s'intitulent "Structure et analyse de la microscopie cryoélectronique de l'échafaudage de signalisation P-Rex1-Gbg".