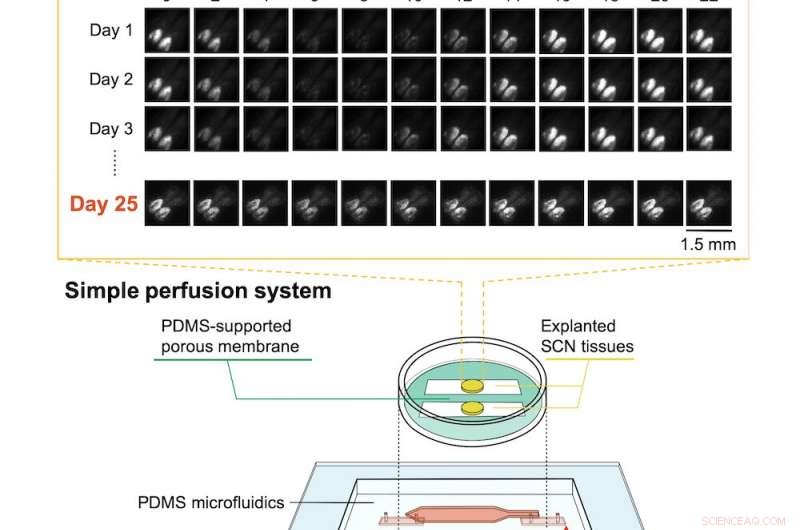
En bas :la configuration du microdispositif avec du tissu de noyau suprachiasmatique (SCN) explanté. En haut :l'activité circadienne rythmique était encore évidente après 25 jours, comme indiqué par l'imagerie par bioluminescence. Crédit :RIKEN
Des chercheurs du RIKEN Center for Biosystems Dynamics Research au Japon ont développé un nouveau système permettant de maintenir la viabilité des tissus pour une étude à long terme une fois transférés d'un animal à un milieu de culture. Le nouveau système utilise un dispositif microfluidique qui peut empêcher les tissus de se dessécher et de se noyer dans le liquide. Une expérience de preuve de concept a montré que le tissu explanté du cerveau de souris restait viable après presque un mois de culture, beaucoup plus longtemps que cela n'est possible avec d'autres méthodes de culture microfluidique, et aussi beaucoup plus simple.
Expérimenter sur des tissus en culture peut faciliter la découverte de médicaments, car les chercheurs peuvent manipuler systématiquement les tissus et tester différents médicaments ou combinaisons de médicaments. Cependant, lors de l'étude d'un système complet dans lequel de nombreuses cellules doivent interagir les unes avec les autres, il s'est avéré difficile de maintenir le tissu « vivant » pendant plus de quelques jours. Le tissu se dessèche rapidement et meurt à moins qu'il ne soit placé dans un milieu de culture humide avec des nutriments appropriés. D'autre part, l'immersion d'un tissu complexe dans un liquide peut endommager le tissu car cela ne permet pas le transfert normal des gaz entre eux.
Pour résoudre ce problème, les scientifiques du RIKEN ont développé un dispositif microfluidique utilisant du polydiméthylsiloxane (PDMS), le matériau souvent utilisé comme antimousse dans les médicaments en vente libre. Le dispositif a un canal semi-perméable entouré d'une membrane artificielle et de parois solides en PDMS. Plutôt que d'être constamment immergé dans un fluide, le tissu a bénéficié de la circulation du milieu de culture au sein du microcanal et du passage à travers la membrane perméable, qui a permis un bon échange de gaz. Cela semble simple, mais trouver les paramètres optimaux s'est avéré difficile. Comme le note le premier auteur Nobutoshi Ota, « Le contrôle du débit du milieu était difficile car le microcanal qui s'est formé entre les parois du PDMS et la membrane poreuse était inhabituel. Cependant, nous avons eu du succès après des modifications par essais et erreurs de la membrane poreuse et des ajustements des débits d'entrée/sortie."
L'équipe a testé l'appareil en utilisant des tissus du noyau suprachiasmatique de souris, une partie complexe du cerveau qui régit les rythmes circadiens. Les souris elles-mêmes étaient des souris knock-in dans lesquelles l'activité du rythme circadien dans le cerveau était liée à la production d'une protéine hautement fluorescente. En mesurant le niveau de bioluminescence provenant du tissu cérébral, ils ont pu voir que les tissus maintenus en vie par leur système restaient actifs et fonctionnels pendant plus de 25 jours avec une belle activité circadienne. En revanche, l'activité neuronale dans les tissus conservés dans une culture conventionnelle a diminué de 6 % après seulement 10 heures.
Cette nouvelle méthode aura plusieurs avantages. A court terme, il sera utile pour observer le développement biologique et tester la réaction des tissus aux médicaments. Les avantages à long terme sont également clairs. "Cette méthode peut être utilisée pour plus que des tissus explantés d'animaux, ", dit Ota. "Cela améliorera également la recherche sur l'organogenèse grâce à la culture et à l'observation à long terme qui sont nécessaires à la croissance des tissus et des organes."
En effet, l'équipe planifie actuellement des expériences à long terme en utilisant leur système pour observer la formation des vaisseaux sanguins et les mouvements des cellules lors de la formation des organoïdes.
Cette étude a été publiée dans la revue Sciences analytiques .