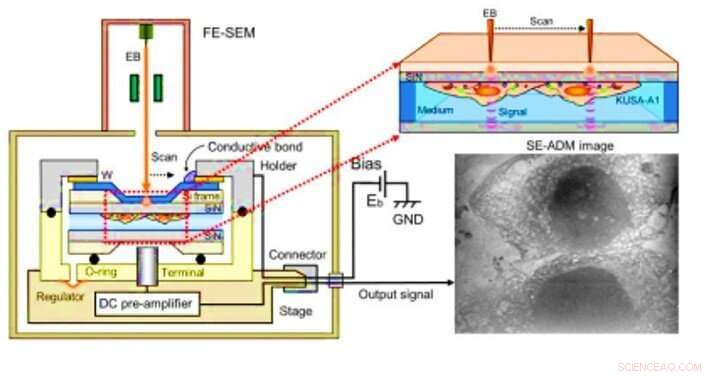
Observation d'ostéoblastes par microscopie diélectrique assistée par électrons à balayage (SE-ADM). (A) SE-ADM haute résolution mis en place pour l'observation des ostéoblastes. Le support d'échantillon liquide comprenant des ostéoblastes est monté sur la scène attachée au préamplificateur, qui est introduit dans la chambre de l'échantillon SEM. Le faisceau d'électrons de balayage est appliqué au film SiN revêtu de W à une faible tension d'accélération. La borne de mesure sous le support détecte les signaux électriques à travers les échantillons liquides. Des structures intracellulaires claires sont visibles (image de droite). Crédit :Avancées scientifiques, doi:10.1126/sciadv.aax0672
La minéralisation est médiée par les ostéoblastes, qui sécrètent des précurseurs minéraux à travers des vésicules matricielles (VM) en tant que processus fondamental chez les vertébrés. Les vésicules sont riches en calcium et en phosphate, contenant des matières organiques telles que des protéines acides. Dans une nouvelle étude maintenant publiée dans Avancées scientifiques , Tomoaki Iwayama et ses collègues des départements de parodontologie, recherche biomédicale, sciences orales, le développement des biomatériaux et de l'anatomie buccale a utilisé la microscopie diélectrique assistée par électrons (SE-ADM) et la microscopie à super-résolution (SRM) pour évaluer les ostéoblastes vivants dans des conditions de minéralisation à une résolution de niveau nano. Ils ont découvert que les vésicules contenant du calcium étaient des corps multivésiculaires contenant des nanovésicules minéralisantes ou des vésicules matricielles (VM). D'après les constats, les MV pourraient être transportés avec les lysosomes et sécrétés par exocytose. Iwayama et al. a présenté la preuve que les lysosomes pouvaient transporter du phosphate de calcium amorphe dans les cellules ostéoblastiques en minéralisation.
Au cours du processus physiologique de minéralisation osseuse, le dépôt de cristaux de phosphate de calcium se produit dans la matrice extracellulaire en tant que processus fondamental chez tous les vertébrés. En 1967, les biologistes Clarke Anderson et Ermanno Bonucci, particules liées aux minéraux visualisées individuellement dans l'espace extracellulaire à l'aide de la microscopie électronique (EM). Les scientifiques ont reconnu plus tard ces particules comme des nano-vésicules minéralisantes ou des vésicules matricielles (VM). Au cours des 50 dernières années d'études EM sur les MV, les biologistes se sont efforcés de comprendre le mécanisme de formation et de sécrétion du MV, qui reste largement méconnu.
Clarifier le processus de minéralisation des cellules vivantes avec l'EM est un défi car la préparation des échantillons pour l'EM nécessite des étapes à la fois sur la fixation chimique et la déshydratation alcoolique. Les étapes peuvent induire des artefacts et même dissoudre ou éliminer des précurseurs minéraux instables en laissant un échafaudage organique connu sous le nom de « fantôme de cristal ». Alors que les scientifiques avaient utilisé avec succès le processus d'EM utilisant des tissus fixés et déshydratés pour visualiser la structure des fibrilles de collagène minéralisées dans les os, étudier les précurseurs minéraux, ils doivent utiliser des procédés cryo-EM pour éviter la déshydratation et faciliter les coûteux, refroidissement extrêmement rapide avec de petits échantillons.
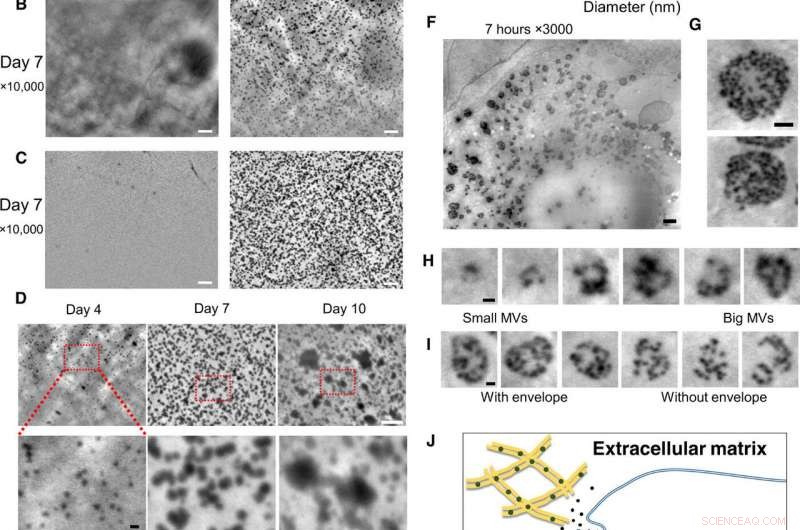
Observation à l'échelle nanométrique d'ostéoblastes vivants dans des milieux de culture, en utilisant le système SE-ADM. (A) Images SE-ADM haute résolution représentatives d'ostéoblastes cultivés avec ou sans milieu ostéogénique pendant 2 jours. Les particules noires n'étaient évidentes que lorsqu'elles étaient cultivées dans des milieux ostéogéniques (à droite, carré en bas). (B) Images SE-ADM haute résolution représentatives d'ostéoblastes cultivés avec ou sans milieu ostéogénique pendant 7 jours. Il y a beaucoup de particules noires lorsqu'elles sont cultivées dans des milieux ostéogéniques (à droite). (C) Images SE-ADM haute résolution représentatives du film SiN après le retrait des cellules. Dans les médias normaux, aucune particule n'est observée (gauche). L'image du film après prélèvement des cellules cultivées dans des milieux ostéogéniques montre de nombreuses particules noires claires dispersées dans toute la zone (à droite). (D) Comparaison des images de particules pendant 4 à 10 jours de culture dans des milieux ostéogéniques. La taille des particules augmente progressivement. (E) Distribution de la taille des particules mesurée pendant 4 à 10 jours de culture en milieu ostéogénique. Environ 900 à 1 100 particules par point de temps ont été mesurées et tracées sous forme d'histogramme. (F) Images SE-ADM haute résolution représentatives d'ostéoblastes cultivés avec des milieux ostéogéniques pendant 7 heures. (G) Les MVB ont des enveloppes gris clair. (H) Couper des images de différentes tailles MVB, y compris les particules. (I) Comparaison des MVB avec ou sans enveloppe grise. (J) Vue schématique de la formation intracellulaire et du transport de MVB dans les ostéoblastes minéralisants. Barres d'échelle, 1 µm dans (A) à (C) et (F); 500 nm dans (G); 200 nm dans (D, bas), (H), et moi). Crédit :Avancées scientifiques, doi:10.1126/sciadv.aax0672
Pour surmonter ces limites dans le présent travail, Iwayama et al. a utilisé un nouveau système microscopique connu sous le nom de microscopie diélectrique assistée par électrons (SE-ADM). La méthode avait déjà atteint une résolution à l'échelle nanométrique et une imagerie à contraste élevé pour les cellules de mammifères dans des milieux aqueux sans coloration. Les scientifiques ont utilisé la même technique (SE-ADM haute résolution) pour explorer la possibilité de visualiser des MV dans des ostéoblastes intacts afin de comprendre la biogenèse du trafic de MV. Pour la lignée cellulaire ostéoblastique, ils ont utilisé la lignée cellulaire ostéoblastique murine (souris) KUSA-A1, à haute capacité ostéogénique in vitro et in vivo. Après culture cellulaire dans des conditions adéquates, Iwayama et al. observé les cellules avec SE-ADM pour identifier les structures intracellulaires normales. Les scientifiques ont observé que les VM s'alignaient sur les fibrilles de collagène après 4 à 10 jours de croissance cellulaire dans des milieux ostéogéniques et que la taille des particules sécrétées augmentait en raison de la fusion ou de la croissance des particules. avec leurs tailles cohérentes avec les rapports précédents pour suggérer qu'il s'agissait bien de MV.
Après un examen plus approfondi avec SE-ADM, ils ont noté l'implication de la voie lysosomale pour transporter et sécréter les VM intraluminales dans un processus similaire à celui des exosomes. De façon intéressante, les exosomes et les VM sont classés comme des vésicules extracellulaires de tailles similaires ; ils sont tous deux sécrétés par les ostéoblastes et ont des fonctions communes lors de la communication cellule-cellule.

Caractérisation des vésicules contenant des minéraux. (A et B) Images de particules à haute résolution avant (A) et après (B) l'élimination des cellules cultivées dans des milieux ostéogéniques pendant 7 jours. Des cartes pseudocolores d'images de particules agrandies indiquées par des flèches rouges sont affichées sur le côté droit de (B). Les particules présentent des structures très lisses sans cristaux. (C) Images de microscopie électronique à balayage (MEB) et analyse spectrométrique EDX de particules sur un film SiN. L'image SEM sur le côté gauche présente le film SiN après élimination des cellules cultivées dans des milieux normaux, qui ne montre aucune particule, et les données spectrométriques EDX ne montrent aucun pic de phosphore et de calcium. En revanche, l'image SEM et les données spectrométriques EDX sur le côté droit montrent des particules et des pics nets de phosphore et de calcium après culture dans des milieux ostéogéniques. (D) Analyse des éléments particulaires à l'aide de cartes spectrométriques EDX. Les particules contenaient du phosphore, calcium, carbone, et l'azote. (E) Spectres Raman obtenus à partir d'ostéoblastes cultivés avec ou sans milieu ostéogénique pendant 23 jours. Un pic pointu de 960 cm-1 n'était évident que dans les milieux ostéogéniques (côté droit). a.u., unités arbitraires. (F) Comparaison des images SE-ADM d'ostéoblastes Alpl knock-out (KO) dans des milieux normaux et ostéogéniques. Les particules ont complètement disparu dans les milieux ostéogéniques. (G) Spectre EDX de particules d'ostéoblastes Alpl KO sur film SiN. Les données spectrométriques EDX gauche présentent le film SiN après élimination des cellules cultivées dans des milieux normaux, qui ne présentent pas de pics de phosphore et de calcium. De plus, les particules dans les milieux ostéogéniques des données du côté droit ne montrent aucun pic de phosphore et de calcium. Barres d'échelle, 1 m dans (A), (C, Haut), (RÉ), et (F); 200 nm dans (B); 100 nm dans (B, droit). Crédit :Avancées scientifiques, doi:10.1126/sciadv.aax0672
A l'étape suivante, Iwayama et al. examiné si ces particules étaient des VM contenant du calcium et/ou du phosphate. Pour ça, ils ont cultivé les cellules dans des milieux ostéogéniques pendant 7 jours et les ont observées en utilisant SE-ADM pour enregistrer des structures très lisses sans facettes cristallines. Cela suggère que les MV ne se sont pas cristallisés mais sont restés amorphes, comme cela a également été enregistré dans une étude précédente. Lorsque les scientifiques ont examiné les MV sur un film de SiN (mononitrure de silicium), ils ont observé des pics nets correspondant au phosphore, calcium, éléments de carbone et d'oxygène. Ils ont confirmé les résultats en utilisant la spectroscopie Raman pour montrer la présence de phosphate de calcium dans les VM.
Les scientifiques ont également étudié les effets de l'hypophosphatasie, une condition médicale codée par le Gène Alpl (phosphatase alcaline) , où les ostéoblastes ne subissent pas de minéralisation in vitro. Pour ça, ils ont édité le génome des cellules ostéoblastiques à l'aide de la technologie d'édition du génome CRISPR-Cas9 pour générer des clones d'ostéoblastes knock-out Alpl. Quand Iwayama et al. examiné les clones knock-out à l'aide de SE-ADM haute résolution, ils n'ont pas observé de MV, ce qui a été confirmé par une analyse spectrométrique en raison de l'absence de pics de phosphore et de calcium.
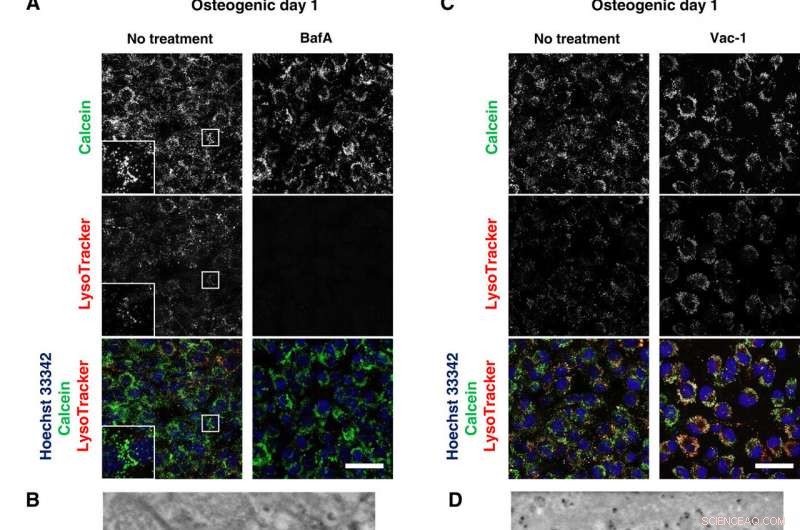
Les inhibiteurs lysosomal bloquent la minéralisation. (A et C) Imagerie confocale en direct d'ostéoblastes traités par BafA 50 nM ou Vac-1 10 M. Les cellules ont été cultivées dans des milieux ostéogéniques contenant BafA ou Vac-1 et colorées avec Hoechst 33342 et LysoTracker Insets montre un grossissement plus élevé et une zone encadrée de chaque canal. (B et D) Images SD-ADM d'ostéoblastes traités par BafA ou Vac-1. Les cellules ont été cultivées dans des milieux ostéogéniques contenant BafA ou Vac-1. (E) Coloration Alizain Red S réalisée sans fixation. Les cellules ont été cultivées dans des milieux ostéogéniques contenant BafA ou Vac-1 et colorées avec des images confocales représentatives d'Alizain Red S.. Barres d'échelle, 50 m dans (A), (C), et (E); 2 µm (B) et (D). Crédit :Avancées scientifiques, doi:10.1126/sciadv.aax0672
Après avoir observé directement la production et la sécrétion de VM à l'aide de SE-ADM, les scientifiques ont en outre étudié l'implication des lysosomes dans le trafic intracellulaire des MV pour observer la minéralisation des ostéoblastes vivants. Ils ont cultivé les cellules dans des milieux ostéogéniques contenant du calcium et les ont colorées avec LysoTracker pour détecter les composants intracellulaires d'intérêt. Iwayama et al. localisé les vésicules remplies de calcéine correspondant aux lysosomes pour suggérer la biogenèse des MVs dans les lysosomes après leur fusion avec la calcéine + vésicules. Les scientifiques ont suivi les expériences avec des études de perte de fonction et d'inhibition fonctionnelle pour déconstruire davantage les voies et examiner les mécanismes d'action intracellulaires pendant la minéralisation des cellules vivantes in vitro.
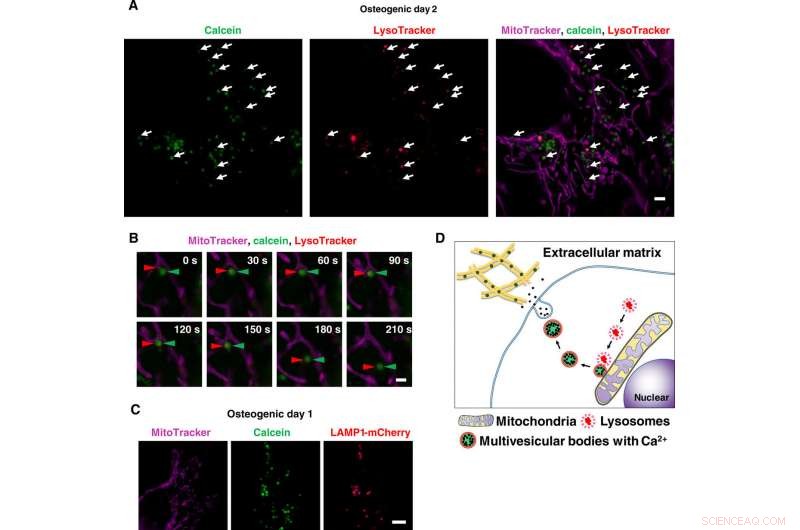
Imagerie en direct à super-résolution des transports de vésicules contenant du calcium via les lysosomes. (A) Instantané d'images SRM en accéléré d'ostéoblastes marqués à la calcéine. Les cellules ont été cultivées avec de la calcéine et colorées avec Lysotracker et MitoTracker. Les flèches blanches indiquent la colocalisation des lysosomes et des vésicules positives à la calcéine. (B) Gros plan sur des images SRM en accéléré d'ostéoblastes marqués à la calcéine. Les pointes de flèches rouges indiquent le lysosome, et les flèches vertes indiquent la calcéine. Une fois les lysosomes fusionnés à des vésicules positives pour la calcéine adjacentes aux mitochondries, ils ont commencé à se déplacer vers l'espace extracellulaire. (C) Image SRM représentative des cellules exprimant LAMP1-mCherry. Les cellules ont été transfectées avec le plasmide LAMP1-mCherry, cultivé avec de la calcéine, et teinté avec MitoTracker. Calcein-positive vesicles matched to LAMP1-mCherry–positive lysosomes. (D) Schematic view of lysosomal involvement in transportation of calcium in mineralizing osteoblasts. Barres d'échelle, 2 μm in (A), 1 μm in (B), and 10 μm in (C). Crédit :Avancées scientifiques, doi:10.1126/sciadv.aax0672
Scientists had previously reported the involvement of mitochondria during mineralization due to the presence of electron-dense calcium and phosphorous-rich granules in osteoblast mitochondria. This was observed with a modified cryotechnique. Par ailleurs, reports also suggest the direct contact of lysosomes and mitochondria with functional significance. When Iwayama et al. stained cells with LysoTracker together with MitoTracker and observed the intracellular components under N-SIM structured illumination super-resolution microscopy (SRM). They observed the presence of most calcein-fulfilled vesicles next to mitochondria and matched with lysosomes. During SRM-time lapse imaging, the scientists further obtained views of intracellular transport of LysoTracker containing vesicles fused to static calcein vacuoles adjacent to mitochondria to validate their hypothesis.
De cette façon, together with observations of other SRM systems and additional cell lines, Tomoaki Iwayama and colleagues proposed a mineralization mechanism. Wherein lysosomes played a central role in intracellular MV biogenesis and trafficking within osteoblasts. It was reasonable to involve lysosomes for osteoblasts to transport amorphous calcium phosphate without crystallization during its transport in the cytosol. The scientists aim to conduct further experiments to understand the regulatory molecules for MVs and investigate if MVs and exosomes have similar constitutions and mechanism underlying their generation, secretion and function. The SE-ADM strategy used in the present work can be installed into existing scanning electron microscopy apparatus at a low cost. The work developed in the study will offer non-invasive, high-resolution imaging at the nanoscale applicable to all scientific fields.
© 2019 Réseau Science X