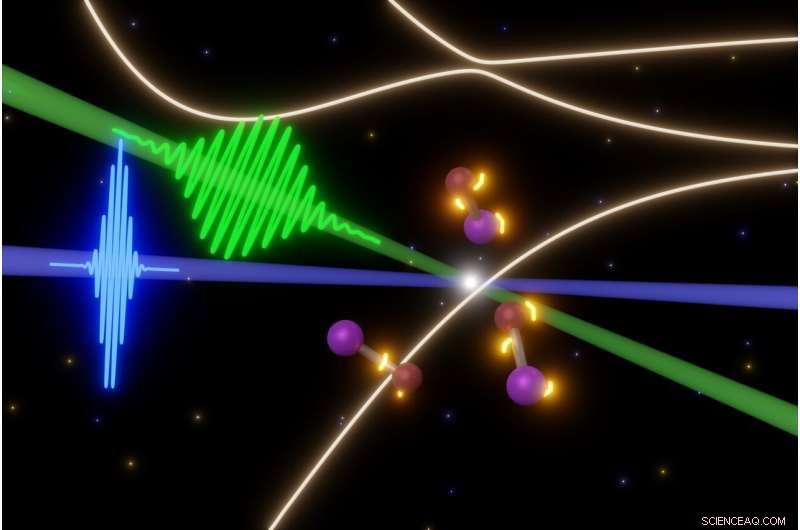
Les scientifiques de l'UC Berkeley sondent les étapes fugaces des réactions photochimiques rapides avec certaines des impulsions laser les plus courtes possibles aujourd'hui. Dans ce cas, une impulsion femtoseconde de lumière visible (vert) déclenche la rupture des molécules de monobromure d'iode (au centre), tandis que les impulsions laser XUV attosecondes (bleues) prennent des instantanés des molécules. Cela leur permet de filmer l'évolution des états électroniques (lumières jaunes autour des molécules) avant que les molécules ne se séparent. Crédit :Yuki Kobayashi, UC Berkeley
Aux beaux jours d'été, la lumière du soleil tout autour de nous se brise en rompant les liens. Liaisons chimiques.
La lumière ultraviolette brise les liens entre les atomes de l'ADN de nos cellules cutanées, potentiellement cancérigène. La lumière UV brise également les liaisons oxygène, créant éventuellement de l'ozone, et clive l'hydrogène d'autres molécules pour laisser des radicaux libres qui peuvent endommager les tissus.
Université de Californie, Berkeley, les chimistes utilisant certaines des impulsions laser les plus courtes disponibles - un quintillionième de seconde - ont maintenant été en mesure de résoudre étape par étape le processus menant à l'explosion d'une liaison chimique, essentiellement faire un film de l'événement. Ils peuvent suivre les électrons qui rebondissent de manière indécise dans divers états de la molécule avant la rupture de la liaison, et les atomes se séparent.
La technique, rapporté la semaine dernière dans le journal Science , aidera les chimistes à comprendre et potentiellement manipuler les réactions chimiques stimulées par la lumière, réactions dites photochimiques. Chimistes et biologistes, en particulier, sont intéressés à comprendre comment les grosses molécules parviennent à absorber l'énergie lumineuse sans rompre aucune liaison, comme cela se produit lorsque les molécules de l'œil absorbent la lumière, nous donner une vision, ou les molécules des plantes absorbent la lumière pour la photosynthèse.
"Pensez à une molécule, rhodopsine, Dans l'oeil, " a déclaré le premier auteur Yuki Kobayashi, un doctorant de l'UC Berkeley. "Quand la lumière frappe la rétine, la rhodopsine absorbe la lumière visible, et nous pouvons voir des choses parce que la conformation de la liaison de la rhodopsine change."
En réalité, lorsque l'énergie lumineuse est absorbée, un lien en torsades de rhodopsine, au lieu de pauses, déclenchant d'autres réactions qui se traduisent par la perception de la lumière. La technique Kobayashi et ses collègues de l'UC Berkeley, les professeurs Stephen Leone et Daniel Neumark, développé pourrait être utilisé pour étudier en détail comment cette absorption de lumière conduit à une torsion après que la molécule a traversé un état excité appelé croisement évité ou intersection conique.
Pour éviter la rupture d'une liaison dans l'ADN, « vous voulez rediriger l'énergie de la dissociation vers une chaleur vibratoire. Pour la rhodopsine, vous voulez rediriger l'énergie de la vibration vers une isomérisation cis-trans, une torsion, " a déclaré Kobayashi. " Ces réorientations de réactions chimiques se produisent de manière omniprésente autour de nous, mais nous n'en avons pas vu le moment réel auparavant."

Yuki Kobayashi fait des ajustements à une expérience dans le sous-sol de Hildebrand Hall. Lui et des chercheurs des laboratoires de Stephen Leone et Daniel Neumark ciblent des molécules dans une chambre à vide avec des lasers femtoseconde et attoseconde pour découvrir comment les molécules absorbent la lumière. Crédit:UC Berkeley photo avec l'aimable autorisation de Robert Sanders
Impulsions laser rapides
Les lasers attosecondes – une attoseconde est un milliardième de milliardième de seconde – existent depuis environ une décennie et sont utilisés par les scientifiques pour sonder des réactions très rapides. Comme la plupart des réactions chimiques se produisent rapidement, ces lasers à impulsions rapides sont essentiels pour « voir » comment les électrons qui forment la liaison chimique se comportent lorsque la liaison se brise et/ou se reforme.
Léone, professeur de chimie et de physique, est un expérimentateur qui utilise également des outils théoriques et est un pionnier dans l'utilisation de lasers attosecondes pour sonder les réactions chimiques. Il a six de ces rayons X et ultraviolet extrême (collectivement, XUV) dans son laboratoire de l'UC Berkeley.
Travailler avec l'une des molécules les plus simples, le monobromure d'iode (IBr) - qui est un atome d'iode lié à un atome de brome - l'équipe de l'UC Berkeley a frappé les molécules avec une impulsion de lumière visible de 8 femtosecondes pour exciter l'un de leurs électrons les plus externes, puis les a sondés avec des impulsions laser attosecondes.
Impulsion du laser XUV attoseconde à des intervalles de 1,5 femtoseconde (une femtoseconde vaut 1, 000 attosecondes), un peu comme utiliser une lumière stroboscopique, les chercheurs ont pu détecter les étapes menant à la rupture des molécules. Le laser XUV à haute énergie a pu explorer les états d'énergie excités par rapport aux électrons internes de la molécule, qui normalement ne participent pas aux réactions chimiques.
"Vous êtes en quelque sorte en train de faire un film sur les trajets de l'électron lorsqu'il s'approche du croisement et la probabilité qu'il suive un chemin ou un autre, " a déclaré Leone. " Ces outils que nous développons vous permettent de regarder les solides, gaz et liquides, mais vous avez besoin des échelles de temps plus courtes (fournies par un laser attoseconde). Autrement, tu ne vois que le début et la fin, et vous ne savez pas ce qui s'est passé d'autre entre les deux."
L'expérience a clairement montré que les électrons externes de IBr, une fois excité, voient soudain une variété d'états ou d'endroits où ils pourraient se trouver et explorent bon nombre d'entre eux avant de décider quel chemin prendre. Dans cette molécule simple, cependant, tous les chemins mènent à l'électron se fixant soit sur l'iode soit sur le brome et les deux atomes s'envolant l'un de l'autre.
Dans les molécules plus grosses, que l'équipe espère bientôt explorer, les électrons excités auraient plus de choix, certains où l'énergie va dans une torsion, comme avec la rhodopsine, ou en vibration moléculaire sans que les molécules se séparent.
« En biologie, il s'avère que l'évolution a sélectionné des choses qui sont extrêmement efficaces pour absorber l'énergie et ne pas rompre un lien, " a dit Leone. " Quand quelque chose ne va pas dans votre chimie, c'est quand vous voyez des maladies surgir. "