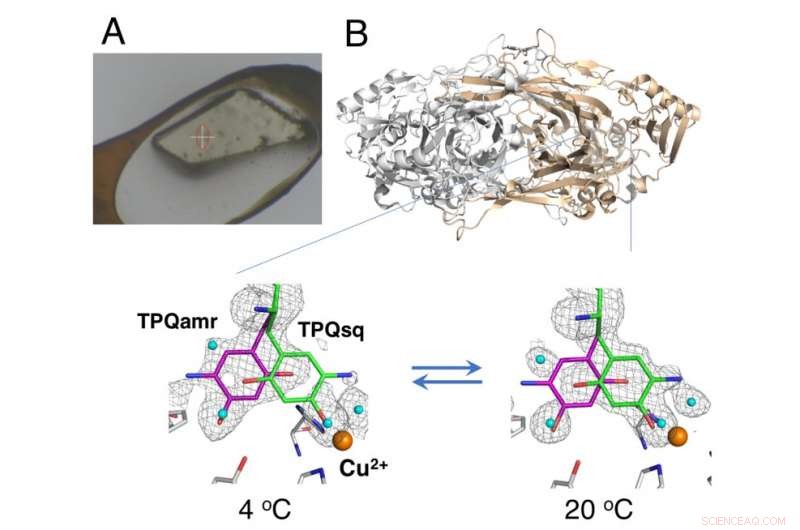
Cristal non cryorefroidi monté à l'aide de la méthode HAG (A) et changement d'équilibre dépendant de la température des intermédiaires catalytiques dans la cuivre amine oxydase (B). Crédit :Université d'Osaka
Les enzymes, les biocatalyseurs constitués de protéines, sont des molécules extrêmement importantes qui catalysent les réactions et les processus dans les organismes vivants. La poursuite des travaux de compréhension de leurs structures et mécanismes réactionnels est donc indispensable pour approfondir nos connaissances et contribuer aux avancées scientifiques et médicales.
Cristallographie aux rayons X - dans laquelle les cristaux de protéines sont exposés à un faisceau de rayons X, résultant en des modèles de diffraction spécifiques qui peuvent être analysés - est la technique la plus largement utilisée pour la détermination de la structure des protéines. La collecte de données en cristallographie aux rayons X consiste généralement à placer des cristaux sous un flux de gaz cryogénique à 100 K; cependant, les conditions cryogéniques ne permettent généralement pas une analyse thermodynamique des changements de conformation des cristaux de protéines. Maintenant, chercheurs de l'Université d'Osaka, Faculté de médecine d'Osaka, Institut japonais de recherche sur le rayonnement synchrotron (JASRI), et RIKEN ont rapporté les détails des changements structurels au cours de la réaction catalytique d'une amine de cuivre oxydase en utilisant une technique non cryogénique. Leurs conclusions ont été publiées dans PNAS .
L'étude a utilisé une méthode « air humide et revêtement de colle (HAG) » développée par JASRI à l'installation de synchrotron SPring-8. Au lieu du refroidissement cryogénique, les cristaux de protéines non congelés ont été recouverts d'un polymère soluble dans l'eau et placés sous un courant d'azote gazeux humide avec une température contrôlée avec précision. Cela a permis au cristal presque nu de rester suffisamment stable pour que l'équipe puisse évaluer l'équilibre entre les conformations structurellement distinctes du cofacteur redox (un composant essentiel de la réaction catalytique) à une température particulière.
« Grâce au contrôle précis de la température que nous avons pu obtenir, nous avons démontré la première analyse thermodynamique cristallo réussie de l'enzyme de travail, " explique l'auteur correspondant de l'étude Toshihide Okajima. " Les analyses thermodynamiques basées sur des mesures cristallines donnent une représentation plus proche des changements structurels que les données acquises à partir d'études de solution, et sont donc plus précieux pour notre compréhension.
En outre, les paramètres thermodynamiques obtenus ont montré un comportement similaire à celui du cytosol à l'intérieur des cellules. On pense donc que les conditions HAG peuvent fournir un modèle utile pour les conditions physiologiques. Diverses autres techniques cristallographiques ont été rapportées pour une utilisation à température ambiante; cependant, ils nécessitent des lasers spécialisés sans rayons X.
"En utilisant la méthode HAG à température contrôlée, nous avons démontré qu'il est possible d'acquérir des informations conformationnelles à l'aide d'un faisceau de rayons X standard, " explique Okajima. " Nous espérons que l'accessibilité de la technique et ses possibilités de fournir des informations thermodynamiques en feront un complément important aux approches cristallographiques actuelles. "