
Les chercheurs de KAUST ont observé que des gouttelettes « pendantes » se formaient à partir de capillaires hydrophobes pour des champs électriques uniformes. Crédit :KAUST; Anastasia Serin
Une expérience, élégant dans sa simplicité, aide à expliquer pourquoi l'eau s'électrise lorsqu'elle touche des surfaces hydrophobes.
Pour plus d'un siècle, les scientifiques ont été intrigués par l'électrification de l'eau lorsqu'elle est mise en contact avec des matériaux hydrofuges ou « hydrophobes », comme la cire de paraffine, huiles, bulles d'air et membranes et feuilles perfluorées. Les mécanismes sous-jacents restent vivement débattus. Maintenant, une équipe d'ingénieurs KAUST a démêlé les rôles de l'eau, l'hydrophobie et les facteurs environnementaux dans ce processus. Cette contribution fondamentale pourrait soutenir le développement de meilleurs dispositifs pour la microfluidique et la nanofluidique et pour la production d'énergie propre.
« Les surfaces hydrophobes sont assez courantes, " note Jamilya Nauruzbayeva, doctorat étudiant et auteur principal de l'étude. "Par exemple, pipettes en polypropylène et perfluorées, tuyaux, les revêtements et les membranes sont des surfaces hydrophobes utilisées pour de nombreuses applications des sciences fondamentales et de l'ingénierie. Ainsi, il est important de comprendre quels mécanismes sont en jeu pour les améliorer et en développer de nouveaux."
Himanshu Mishra, qui a conçu et dirigé cette étude, dit qu'il réfléchit à ce problème depuis plus de cinq ans. « Sonder la surface de l'eau est une entreprise extrêmement difficile car l'épaisseur des interfaces est à l'échelle moléculaire, qu'aucune technique expérimentale ne peut sonder sans ambiguïté, " explique Mishra.
« C'est un sujet électrisant lors des conférences sur l'eau ; au fil des ans, par l'expérimentation et la théorie, plusieurs facteurs et mécanismes concurrents ont été proposés, " dit Mishra. Ceux-ci incluent, par exemple, la nature dipolaire de la molécule d'eau; le transfert de charge instantané entre les molécules d'eau interfaciales et les hydrophobes; la dissolution du CO2 atmosphérique dans l'eau; et l'accumulation interfaciale d'ions intrinsèques de l'eau (c'est-à-dire, ions hydroxyde et hydronium).
Mishra et ses étudiants ont fait équipe avec Carlos Santamarina pour concevoir des expériences élémentaires pour démêler le rôle de l'eau, ses ions et son pH, hydrophobie des surfaces, et les facteurs environnementaux, comme l'humidité relative et la teneur en CO2.
En utilisant un condensateur à plaques parallèles, ils ont exposé des gouttelettes « pendantes » formées de capillaires hydrophobes répondant à des champs électriques uniformes. La compétition entre leur poids et la force électrique a fait basculer les gouttelettes pendantes, qui a révélé leur charge.
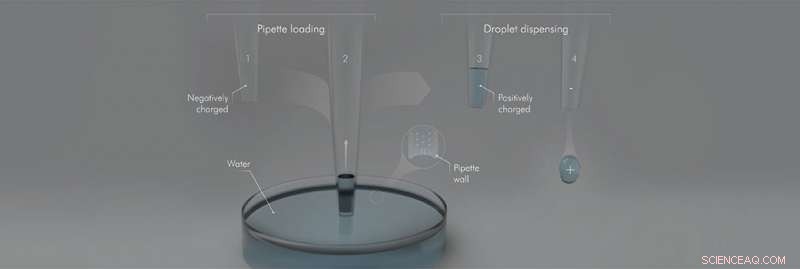
Les surfaces hydrophobes (1) sont intrinsèquement chargées négativement et ainsi lorsque le capillaire hydrophobe (2) aspire de l'eau du réservoir d'eau (neutre), il attire sélectivement les cations (c'est-à-dire ions chargés positivement) qui peuplent la double couche électrique (représentée dans l'insert). Ainsi, lorsque le capillaire (3) est retiré du réservoir d'eau, il transporte de l'eau avec une charge nette positive laissant une charge égale et opposée dans le réservoir d'eau. Lorsque l'eau est distribuée (4), l'hydrophobie garantit que tout le volume d'eau est expulsé avec la charge positive en excès. Crédit :Nauruzbayeva et al.; KAUST; Ivan Gromicho
Prochain, ils ont utilisé un électromètre - capable de mesurer des charges jusqu'à quelques électrons - pour mesurer la charge des réservoirs d'eau d'où les gouttelettes ont été retirées. Ils ont découvert que lorsqu'une goutte d'eau est retirée à l'aide d'un capillaire hydrophobe, le réservoir d'eau acquiert une charge négative égale et opposée. Ce n'est pas le cas lorsque vous utilisez un capillaire en verre.
« À partir de ces résultats expérimentaux, nous avons pu en déduire que ces surfaces hydrophobes portaient une charge de surface négative, même dans l'air, ce qui est assez contre-intuitif, " explique Nauruzbayeva. " Lorsque la surface est enfoncée dans l'eau, les ions positifs sont attirés vers lui et les ions négatifs sont repoussés. L'hydrophobie garantit que le liquide s'éloigne de la surface sans laisser de film."
"Cette découverte est née d'une compréhension approfondie des concepts scientifiques associée à une élégance scientifique simple, " dit Santamarina. Mishra est d'accord en concluant que " la force de notre contribution réside dans sa simplicité ".