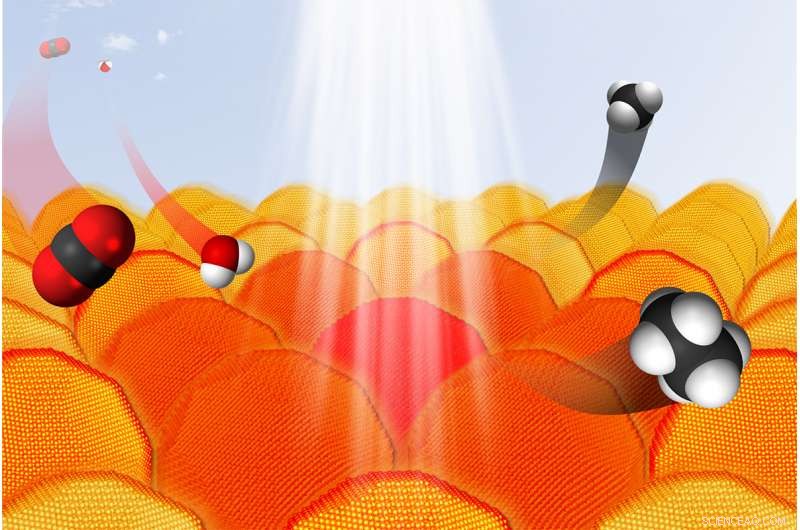
Dans les bonnes conditions, les nanoparticules d'or absorbent la lumière et transfèrent des électrons à d'autres réactifs. Ce procédé peut être utilisé pour convertir le CO2 et l'eau en hydrocarbures. Dans le graphique, les atomes de carbone sont noirs, les atomes d'oxygène sont rouges et les atomes d'hydrogène sont blancs. Crédit :Sungju Yu/Jain Lab/Université de l'Illinois
Les scientifiques font un pas de plus vers la construction d'un système de recyclage du carbone capable de récupérer l'énergie solaire pour convertir efficacement le CO2 et l'eau en combustibles liquides. En optimisant de nombreuses parties du système, disent les chercheurs, ils peuvent maintenant conduire des réactions chimiques à deux électrons, une avance substantielle sur les réactions à un électron, qui sont inefficaces sur le plan énergétique.
La recherche, rapporté dans le journal Chimie de la nature , aidera ceux qui espèrent trouver un moyen de convertir l'excès de dioxyde de carbone dans l'atmosphère en sources d'énergie utiles, a déclaré Prashant Jain, professeur de chimie à l'Université de l'Illinois, qui a dirigé la nouvelle recherche.
"Les scientifiques se tournent souvent vers les plantes pour avoir un aperçu des méthodes pour transformer la lumière du soleil, du dioxyde de carbone et de l'eau en carburants, " il a dit.
Lorsque l'énergie solaire frappe les feuilles des plantes, il excite les électrons de la chlorophylle. Ces électrons excités conduisent finalement la chimie qui transforme le dioxyde de carbone et l'eau en glucose.
"Beaucoup de ces réactions chimiques sont multiprotons, réactions multiélectroniques, " dit Jain.
Mais au lieu de compter sur des pigments végétaux biodégradables pour convertir l'énergie lumineuse en énergie chimique, les scientifiques se tournent vers quelque chose de mieux :des catalyseurs métalliques riches en électrons comme l'or, qui, à des intensités lumineuses et des longueurs d'onde spécifiques, peuvent transférer des électrons et des protons photoexcités aux réactifs sans être dégradés ou épuisés.
« Dans notre étude, nous avons utilisé des particules d'or sphériques de 13 à 14 nanomètres, " dit Jain. " Les nanoparticules ont des propriétés optiques uniques, en fonction de leur taille et de leur forme."
Lorsqu'il est enduit d'un polymère et en suspension dans l'eau, par exemple, les nanoparticules absorbent la lumière verte et reflètent une couleur rouge foncé. Sous excitation lumineuse, les nanoparticules transfèrent des électrons aux molécules sondes, qui change alors de couleur. Cela permet aux scientifiques de mesurer l'efficacité des réactions de transfert d'électrons.
"Les chercheurs ont réussi dans le passé à utiliser la photochimie et ces matériaux absorbant la lumière pour transférer un électron à la fois, " Jain a dit. "Mais dans la nouvelle étude, nous avons identifié les principes, les règles et les conditions dans lesquelles un catalyseur à nanoparticules métalliques peut transférer deux électrons à la fois."
En faisant varier l'intensité de la lumière laser utilisée dans les expériences, Jain et ses collègues ont découvert qu'à quatre à cinq fois l'intensité de l'énergie solaire, les nanoparticules d'or du système pourraient transférer jusqu'à deux électrons à la fois de l'éthanol à une sonde avide d'électrons.
Les réactions à deux électrons sont de loin préférables aux réactions à un électron, dit Jain.
"Vous avez besoin d'une paire d'électrons pour faire une liaison entre les atomes, " dit-il. " Quand vous ne fournissez pas une paire d'électrons - et une paire de protons pour neutraliser la perte d'électrons - vous finissez par produire des radicaux libres, qui sont très réactifs et peuvent réagir en retour, gaspiller l'énergie que vous avez utilisée pour les créer. Ils peuvent également réagir avec d'autres produits chimiques ou détruire votre catalyseur."
Jain a également conclu que les expériences récentes que son laboratoire a menées à l'aide du même système impliquaient également des multiélectrons, transferts multiprotons. Dans ces expériences, son laboratoire a converti le CO2 en éthane, un composé bicarboné plus riche en énergie que le méthane, qui ne contient qu'un seul carbone. Jain et ses collègues espèrent éventuellement produire du propane, qui a un squelette à trois carbones, et butane, qui en a quatre.
« Du point de vue de la chimie, il est intéressant de comprendre les règles d'enchaînement des atomes de carbone, " dit Jain. " En transférant plus d'un électron à la fois, l'activation de plus d'une molécule de dioxyde de carbone à la fois à la surface du catalyseur à nanoparticules peut nous donner accès à des hydrocarbures supérieurs. »
Bien que les nouvelles découvertes représentent un pas en avant important, beaucoup plus de travail doit être fait avant que cette technologie soit prête à être utilisée et étendue pour relever les défis actuels, dit Jain.
"Il y a encore un long chemin à parcourir. Je pense qu'il nous faudra au moins une décennie pour trouver une séquestration pratique du CO2, Fixation du CO2, technologies de formation de combustible qui sont économiquement réalisables, ", a-t-il déclaré. "Mais chaque aperçu du processus améliore le rythme auquel la communauté de la recherche peut évoluer."