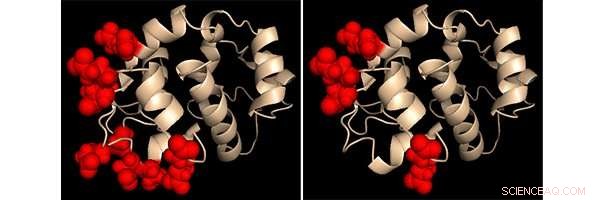
Représentation par un chimiste des protéines de la région de détection du calcium dans deux variantes de la protéine STIM1 modifiées. Les sites qui ont été modifiés sont mis en évidence dans chaque cas comme des sphères rouges. Le comportement de ces deux protéines modifiées a fourni des informations clés sur la façon dont STIM1 détecte les changements dans les niveaux de calcium Crédit :Dr Patrick Hogan, Institut d'immunologie de La Jolla
Toutes les cellules de mammifères ont besoin d'un approvisionnement immédiat en ions calcium pour exécuter des fonctions aussi diverses que la neurotransmission, contraction musculaire, libération d'hormones, ou des réponses immunitaires. Cette exigence est si fondamentale que les cellules se protègent des catastrophes en stockant le calcium dans un réseau de citernes intracellulaires appelé réticulum endoplasmique, ou ER. Puis, car les cellules perdent du calcium dans le cadre de leur routine quotidienne, des canaux s'ouvrent dans la membrane cellulaire permettant l'afflux de calcium de l'extérieur pour remplir les réserves du RE et maintenir les fonctions cellulaires induites par le calcium.
Deux études récemment publiées par les chercheurs du La Jolla Institute for Immunology (LJI) Patrick Hogan, Doctorat., et Aparna Gudlur, Ph.D.—un article paru au début de l'année dans Rapports de cellule et l'autre le 31 octobre 2018, problème de Communication Nature — rapporter comment une protéine détectant le calcium appelée STIM1 signale qu'il est temps d'initier la récupération du calcium, puis transmet ce message à son partenaire, le canal calcique ORAI. Cet ensemble de travaux jette les bases de nouvelles façons de manipuler la signalisation aberrante du calcium dans le système immunitaire, notamment dans le cadre d'une maladie auto-immune ou inflammatoire.
"Nous savons depuis une décennie que la protéine STIM1 se déplace vers la membrane plasmique pour ouvrir les canaux ORAI lorsque les niveaux de calcium du RE baissent, " dit Hogan, professeur à la Division de la signalisation et de l'expression génique. "Nos travaux récents montrent comment la machinerie STIM fonctionne au niveau moléculaire. Comprendre ces mécanismes est essentiel, car le calcium est important pour une panoplie de réponses immunitaires."
Les Rapports de cellule L'article révèle comment la protéine STIM1 s'allonge lorsqu'elle passe d'un état de repos à un état activé lorsque les réserves de calcium diminuent. STIM1 est une protéine transmembranaire qui traverse la paroi du RE :une extrémité enfonce une queue en forme de bandelette réactive à l'intérieur de la réserve; au repos, état riche en calcium, l'autre bras dépasse de la salle d'urgence mais reste plaqué contre le mur de la salle d'urgence, déconnecté des canaux ORA1 dormants qui parsèment la membrane cellulaire.
Le groupe a défini ce qui se passe lorsque les niveaux de calcium chutent en construisant et en testant le comportement des protéines STIM1 génétiquement modifiées dans des cellules en culture. L'analyse a montré que la perte de calcium de la queue du capteur provoquait le rapprochement des régions transmembranaires des paires de protéines STIM1 à l'intérieur de la paroi du RE, incitant les bras externes à s'étendre vers la membrane cellulaire. Ce changement de forme a rapproché STIM1 suffisamment des canaux ORAI pour les atteindre et les ouvrir, permettant au calcium de refluer dans les cellules.
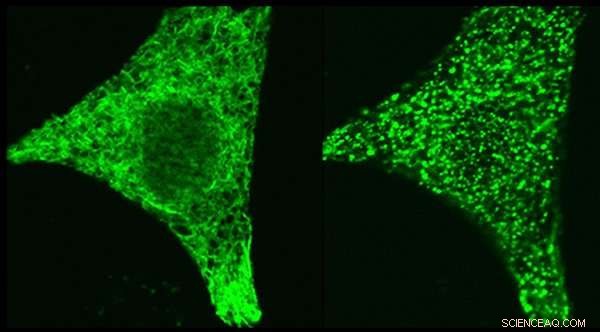
Images au microscope de la protéine régulatrice STIM1 - marquée génétiquement avec une étiquette fluorescente verte - dans la même cellule avant stimulation (panneau de gauche) et après stimulation (panneau de droite). STIM1 relocalise, lorsque la cellule est stimulée, vers des sites où il peut déclencher le canal calcique ORAI1. Le mécanisme qui initie ce mouvement STIM1 a fait l'objet des deux études. Crédit :Dr Aparna Gudlur, Institut d'immunologie de La Jolla
"Le premier article a montré comment STIM1 communique avec une protéine de canal dans la membrane plasmique via un changement structurel, ", dit Hogan. "Notre dernier article fait remonter ce processus dans le temps et révèle comment la perte de calcium à l'intérieur de l'ER initie ce changement."
Mettre tout simplement, l'article le plus récent se concentre sur le fonctionnement de la jauge de détection de calcium de STIM1. Précédemment, les chimistes des protéines ont découvert que le calcium à l'intérieur du RE se lie à un motif structurel dans la queue STIM1 appelé « main EF » et ont proposé que lorsque la main était vide, STIM1 a activé ORAI. Gudlur, un instructeur dans le laboratoire Hogan et le premier auteur du nouvel article, explique que ce n'est pas si simple. "Nous rapportons maintenant que plusieurs calciums se lient non seulement à la main EF mais à d'autres sites dans le domaine STIM1 ER, et que les sites dépendent les uns des autres, " dit-elle. " Cela révise le concept de la façon dont STIM1 est activé. "
Non seulement que, mais selon Hogan, la croyance dominante était que la dissociation du calcium fait que la région en forme de bandelette réactive de STIM1 à l'intérieur du RE se déplie de façon spectaculaire et prend une structure chaotique, un désordre jugé nécessaire à l'activation d'ORAI. "Nous montrons maintenant que lorsque le calcium est faible dans le RE, cette région ne se déploie pas mais acquiert plutôt une structure nouvelle mais stable qui favorise l'interaction avec le canal ORAI, " dit-il. " C'est important parce que cela signifie que l'interaction pourrait être ciblée par des inhibiteurs. "
En réalité, les sociétés pharmaceutiques ont déjà cherché à développer des médicaments pour bloquer les canaux calciques ORAI afin d'arrêter les réponses immunitaires dépendantes du calcium dans les maladies auto-immunes ou dans les affections inflammatoires comme la pancréatite aiguë. Certains médicaments bloquant ORAI sont actuellement en essais cliniques de phase I et II et semblent jusqu'à présent non toxiques. Mais leur potentiel thérapeutique reste inconnu.
Gudlur, qui a joué un rôle de premier plan dans les deux études, spécule que le développement de bloqueurs directs ORAI/STIM1 en tant que thérapies peut n'être qu'une première étape, car les deux protéines sont communes à de nombreux types de cellules. « Cibler les canaux ORAI comme moyen de bloquer la signalisation calcique en excès uniquement dans certaines cellules peut nécessiter une plus grande spécificité, " dit-elle. " Notre travail est une première étape dans l'identification de facteurs spécifiques aux cellules capables de moduler l'activité d'ORAI/STIM1. Une fois que nous les trouvons, des criblages de médicaments ciblant ces facteurs seraient nécessaires. »
Hogan convient que la découverte de médicaments repose sur une base d'exploration. "Les personnes qui mènent des recherches fondamentales doivent examiner les processus cellulaires fondamentaux, " il dit, notant que plus de 20 ans se sont écoulés entre la découverte de la protéine du point de contrôle immunitaire CTLA4 et l'approbation par la FDA du blocage du point de contrôle immunitaire comme traitement du mélanome. (Remarque :quatre jours après cet entretien, les "découvreurs" nommés par Hogan ont reçu le prix Nobel de physiologie et médecine 2018). "Si vous ne bricolez pas les bases d'une cellule, vous ne sauterez jamais en avant. Nous ne savons pas toujours d'où viendront les thérapies."