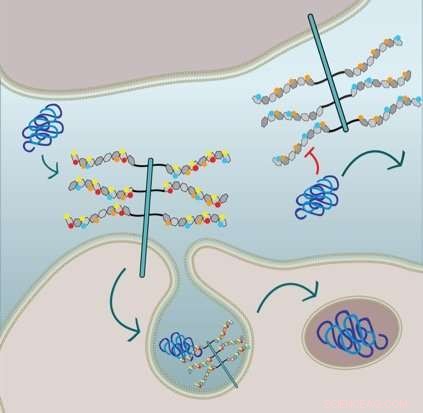
La figure montre que l'absorption cellulaire des fibrilles de tau nécessite une 6-O-sulfatation et une N-sulfatation des chaînes latérales HSPG :La cellule dans la moitié supérieure est génétiquement modifiée et manque de N-sulfation (cercles rouges) et 6-O-sulfatation (cercles jaunes) et donc, l'absorption des fibrilles tau est inhibée. Crédit :Sandi Jo Estill-Terpack, Barbara Stopschinsky
Les vampires peuvent transformer les humains en vampires, mais pour entrer dans la maison d'un humain, ils doivent être invités. Des chercheurs de l'UT Southwestern Medical Center, écrit dans le Journal de chimie biologique , ont découvert des détails sur la façon dont les cellules invitent à l'intérieur des protéines corrompues qui peuvent corrompre les protéines normales, conduisant à des maladies neurodégénératives telles que les maladies d'Alzheimer et de Parkinson. Comprendre les détails moléculaires de la façon dont ces protéines se propagent d'une cellule à l'autre pourrait conduire à des thérapies pour arrêter la progression de la maladie.
La maladie d'Alzheimer et la maladie de Parkinson sont associées à des protéines particulières dans le mauvais repliement du cerveau, agréger, et induire le mauvais repliement et l'agrégation des protéines normales. Le groupe de Marc Diamond à UT Southwestern a découvert en 2013 que pour entrer dans de nouvelles cellules et propager un mauvais repliement, les protéines associées à la maladie tau, l'alpha-synucléine et le bêta-amyloïde doivent se lier à un type de molécule de sucre-protéine appelée protéoglycane héparane sulfate (HSPG) à la surface de la cellule. Cette liaison incite la cellule à introduire la protéine corrompue à l'intérieur. Dans la nouvelle étude, le groupe a cherché à mieux comprendre le fonctionnement de ce processus.
« La question était, à quel point ce (processus) est-il spécifique ? Ou n'est-ce pas spécifique du tout ?" a demandé Barbara Stopschinski, le médecin et chercheur du laboratoire de Diamond qui a supervisé le nouveau travail. Quels étaient les détails de la communication chimique entre HSPG et tau qui a déclenché l'entrée de tau dans les cellules ? Et ce processus était-il différent pour l'alpha-synucléine (associée à la maladie de Parkinson), bêta-amyloïde et tau (tous deux associés à la maladie d'Alzheimer) ?
Les HSPG peuvent être de différentes tailles et structures; ils peuvent être décorés de différents motifs de sucres, et les sucres peuvent eux-mêmes contenir différents motifs de groupes contenant du soufre (parties sulfate). Stopschinski a systématiquement testé comment différents modèles de fractions sulfate affectaient la liaison et l'absorption dans les cellules de l'alpha-synucléine, bêta-amyloïde et tau.
Elle a découvert que le tau mal replié ne pouvait entrer dans les cellules qu'à travers un HSPG très spécifiquement décoré et modifié. bêta-amyloïde et alpha-synucléine, d'autre part, étaient plus flexibles dans les types de fragments de sulfate qui ont déclenché leur absorption. Par ailleurs, Stopschinski a identifié les enzymes dans les cellules qui ont créé des modèles de sulfatation particuliers dans les HSPG. Lorsque ces enzymes ont été supprimées, le tau mal replié n'était plus repris dans les cellules, probablement parce que les décorations en sucre HSPG et les motifs de sulfatation ont changé, ce qui signifie que le tau mal replié ne connaissait plus le mot de passe moléculaire.
L'équipe veut maintenant comprendre si ces processus fonctionnent de la même manière dans le cerveau que dans les cultures de cellules cérébrales. Diamond espère que comprendre comment les protéines corrompues se déplacent entre les cellules du cerveau permettra de les arrêter.
"Il y a quelque chose de très remarquable sur l'efficacité avec laquelle une cellule absorbera ces agrégats, amenez-les à l'intérieur et utilisez-les pour en faire plus, " Diamond a déclaré. "Cette connaissance a des implications importantes pour notre compréhension de l'aggravation des maladies neurodégénératives au fil du temps. Parce que nous avons identifié des enzymes spécifiques qui peuvent être inhibées pour bloquer ce processus, cela pourrait conduire à de nouvelles thérapies."