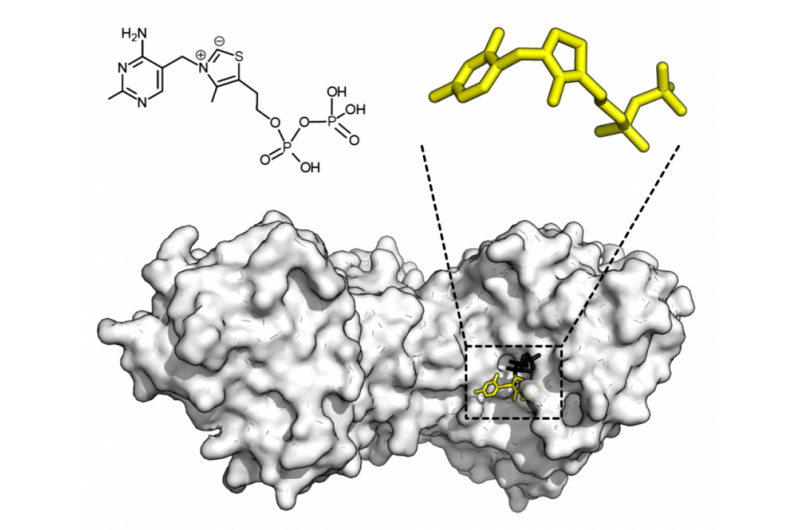
Structure chimique du pyrophosphate de thiamine et structure protéique de la transcétolase. Cofacteur thiamine pyrophosphate en jaune et substrat xylulose 5-phosphate en noir. Crédit :Thomas Shafee/Wikipédia
Des chercheurs de l'Université McGill ont inventé une nouvelle technique pour mesurer la rapidité avec laquelle les médicaments interagissent avec leurs cibles moléculaires. La découverte offre aux scientifiques une nouvelle façon d'étudier l'efficacité de médicaments candidats qui auraient autrement pu être négligés.
La nouvelle méthode repose sur le principe de l'inhibition enzymatique. D'innombrables produits pharmaceutiques, allant des antibiotiques aux médicaments de chimiothérapie, agissent en bloquant l'action des enzymes, et la recherche de nouvelles substances inhibitrices d'enzymes reste un axe majeur du développement de médicaments.
Dans un article publié en Communication Nature , l'équipe de McGill, animé par les professeurs de chimie Nicolas Moitessier et Anthony Mittermaier, démontrent l'utilisation de la calorimétrie de titrage isotherme (ITC) pour mesurer la chaleur générée par l'activité enzymatique et ainsi les taux auxquels les substances inhibitrices ont bloqué cette activité.
"Une différence clé entre l'ITC et les autres méthodes est que l'ITC mesure directement la vitesse de réaction, ", explique Mittermaier.
Les méthodes existantes pour mesurer l'activité enzymatique examinent cette activité indirectement, en mesurant les variations de concentration provoquées par la catalyse enzymatique en fonction du temps. Ces mesures dépendent souvent de réactifs spéciaux qui changent de couleur ou de fluorescence sous l'action de l'enzyme, et nécessitent un test unique à développer pour chaque enzyme étudiée.
Parce que l'ITC mesure la production de chaleur - une caractéristique quasi universelle des réactions chimiques - il peut être appliqué à à peu près n'importe quelle enzyme.
" L'ITC est aussi proche que possible d'un test enzymatique universel, " dit Mittermaier.
En plus de sa généralité, la méthode ITC donne une lecture directe de l'activité enzymatique car elle détecte le flux de chaleur en temps réel. En offrant une fenêtre directe sur la réaction, L'ITC offre aux chercheurs une meilleure compréhension des mécanismes par lesquels l'inhibition enzymatique se produit. C'est généralement très difficile, et parfois presque impossible, pour obtenir ces informations à partir de tests conventionnels.
La nature en temps réel de l'ITC est particulièrement prometteuse pour les chercheurs étudiant les inhibiteurs covalents. Ces molécules fortement liantes ont un potentiel en tant que médicaments à action prolongée, mais étaient auparavant tombées en désuétude dans le développement de médicaments en raison de problèmes de toxicité. L'aperçu qu'offre l'ITC sur la relation entre la structure moléculaire d'un inhibiteur et la façon dont il réagit avec sa cible soutiendra un intérêt renouvelé pour les inhibiteurs covalents et facilitera le travail de développement de médicaments à la fois très efficaces et sûrs.