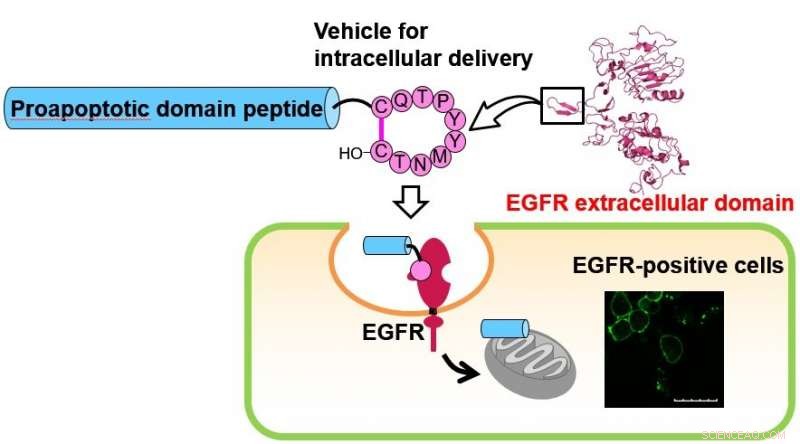
Décapeptide cyclique, qui imite le bras de dimérisation du récepteur EGF (EGFR), était auparavant capturé dans les cellules. Les auteurs ont découvert le potentiel prometteur de ce peptide en tant que véhicule d'administration intracellulaire dirigé vers les cellules positives pour l'EGFR. La délivrance cellulaire du peptide du domaine pro-apoptotique (PAD) a été contestée par conjugaison avec le peptide cyclique ci-dessus. L'absorption cellulaire du peptide conjugué, qui était composé du peptide cyclique, le peptide PAD et un lieur clivable avec une protéase, a été évaluée par traitement de cellules positives pour l'EGFR. Une suppression significative de la prolifération par le peptide conjugué a été montrée dans un essai de viabilité cellulaire. Crédit :Département de chimie médicinale, TMDU
Dans le domaine de la thérapeutique anticancéreuse, les peptides antimicrobiens cationiques (AMP) ont gagné en importance en raison de leur activité cytotoxique et anticancéreuse dans les cellules cancéreuses résistantes aux médicaments. Les peptides sont des composés constitués de deux ou plusieurs acides aminés liés dans une chaîne.
Un peptide de domaine pro-apoptotique (PAD) imperméable à la membrane [KLAKLAK]2 est connu pour être un agent antimicrobien et provoquer une rupture de la membrane mitochondriale, suivi de la mort cellulaire. La plupart des AMP, y compris le PAD, ont des fonctions antitumorales en raison d'un système de défense multifonctionnel de l'hôte d'organismes multicellulaires; cependant, ils ne peuvent pas pénétrer les membranes cellulaires, et seul, ils ont peu de cytotoxicité.
Des études antérieures ont montré que les peptides PAD pénètrent dans les cellules par leur conjugaison avec des peptides pénétrant dans les cellules (CPP). Une équipe de chercheurs de l'Université médicale et dentaire de Tokyo (TMDU) a montré un décapeptide cyclique, appelé peptide 1, imite le bras de dimérisation du récepteur EGF (EGFR). L'EGFR est impliqué dans les transductions du signal cellulaire et la progression du cancer, et est surexprimé dans de nombreuses cellules cancéreuses. D'où, la liaison du peptide 1 à l'EGFR pourrait potentiellement retarder la croissance du cancer.
Dans sa dernière étude, l'équipe visait à vérifier la sélectivité du peptide 1 vis-à-vis de l'EGFR et a étudié son efficacité en tant que véhicule pour l'administration intracellulaire aux cellules. Les chercheurs ont rapporté leur étude en Chimie bioconjuguée .
"En tant qu'étude de preuve de concept, la délivrance cellulaire du peptide PAD a été contestée par conjugaison avec le peptide 1, " explique le premier auteur de l'étude Kei Toyama. " L'absorption cellulaire d'un peptide conjugué 2, composé de peptide 1, le peptide PAD, et un lieur clivable avec une protéase, a été évalué par le traitement d'une lignée cellulaire de cancer du poumon EGFR-positive."
Une suppression significative de la prolifération par le peptide 2 a été observée dans les tests de viabilité cellulaire, alors que conjugué 3, qui ne contient pas de peptide 1, n'avait pas d'activité significativement inhibitrice dans les lignées cellulaires. Notamment, le peptide PAD seul n'a eu aucun effet sur les cellules.
"Nos résultats suggèrent que le peptide 1 est un composé phare prometteur en tant que nouveau véhicule d'administration intracellulaire pour des peptides thérapeutiquement efficaces, ", dit l'auteur principal Hirokazu Tamamura. "En outre, conjugué 2, avec son activité d'induction de l'apoptose, peut être exploré en tant que nouveau peptide apoptotique qui pourrait contribuer au développement de réactifs anticancéreux basés sur les fonctions AMP."