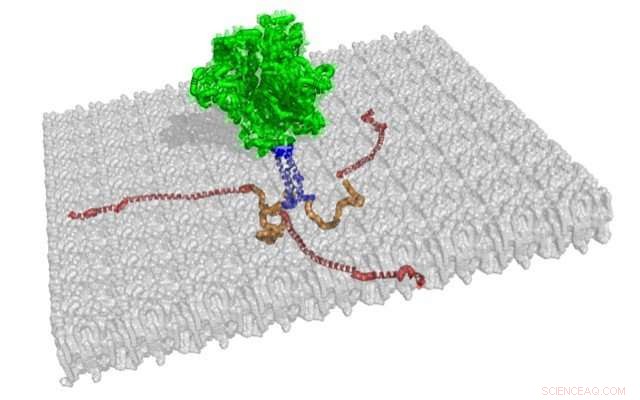
Les structures de trois queues cytoplasmiques associées à la membrane de gp41 sont représentées en rouge et orange, à partir de cette illustration de la structure de pointe trimérique. Le reste de cette protéine d'enveloppe du VIH-1, qui est amarré sur une membrane grise, sont les structures de gp120 et gp41, représenté en vert, et le segment transmembranaire, représenté en bleu. Crédit :Jamil Saad
Une équipe de l'Université d'Alabama à Birmingham dirigée par Jamil Saad, Doctorat., a résolu la dernière structure protéique inconnue du VIH-1, le rétrovirus qui peut causer le SIDA.
Connaissance de cette structure, appelée queue cytoplasmique de la protéine gp41, aidera les chercheurs à mieux comprendre comment le virus infecte les cellules humaines et comment les virus descendants sont assemblés et libérés des cellules infectées. La queue cytoplasmique semble jouer un rôle clé dans l'assemblage du virus pour aider à incorporer les structures de pointe d'enveloppe à la surface des particules virales.
"Si nous sommes capables d'inhiber l'incorporation de la protéine d'enveloppe, nous inhibons la réplication virale, " Saad a déclaré. "Cela désarmerait le virus et empêcherait la maladie. La queue cytoplasmique est un élément essentiel de l'infectiosité."
La structure de la queue cytoplasmique de gp41 était une tâche extrêmement difficile à résoudre, dit Saad, professeur agrégé de microbiologie à l'UAB.
"C'était le projet le plus difficile que j'ai rencontré au cours des 20 dernières années. Plusieurs fois, j'étais sur le point d'arrêter, mais j'ai un groupe de laboratoire très persistant."
Saad connaît de nombreux autres groupes de recherche qui n'ont pas pu déterminer la structure moléculaire.
Un problème pour Saad et ses collègues de l'UAB est survenu alors qu'ils tentaient d'exprimer la queue cytoplasmique de gp41 dans des cellules d'E. coli en croissance. Au lieu d'un produit intact, une enzyme bactérienne coupait la protéine pendant l'expression de la protéine. "Nous n'avons jamais vu cela pour aucune autre protéine, ", a déclaré Saad. Les chercheurs ont découvert qu'ils devaient limiter l'expression des protéines à seulement deux heures. Même alors, 70 pour cent de la queue cytoplasmique ont été coupés et seulement 30 pour cent ont été laissés intacts.
Il a fallu plus de deux ans et des efforts avec 100 conditions différentes pour obtenir un bon produit, dit Saad. « Maintenant, nous pouvons le faire en deux jours. »
La coupe s'est avérée utile. Un morceau était soluble, et le groupe Saad a pu examiner sa structure par résonance magnétique nucléaire, ou RMN. L'autre morceau était insoluble, les chercheurs ont donc dû utiliser une solution de micelles (des agrégats de type lipide ou détergent dispersés dans une solution) pour laisser le morceau insoluble former sa structure dans un environnement semblable à une membrane. Comme les conditions de croissance, les chercheurs ont eu besoin de nombreux essais pour trouver des conditions membranaires appropriées. Une solution micellaire est quelque peu similaire au vinaigre et à l'huile après l'avoir secouée vigoureusement pour disperser de minuscules gouttelettes d'huile dans le pansement.
De nouveau, La RMN a été utilisée pour résoudre la structure insoluble lors de son incorporation dans les micelles.
Quand le groupe Saad a mis des molécules de l'intact, queue cytoplasmique pleine longueur de gp41 dans la solution micellaire, ils ont constaté que les structures de chacune des pièces étaient maintenues dans la structure intacte.
Ils ont découvert que l'extrémité N-terminale de la queue cytoplasmique de gp41, mesurer 45 résidus d'acides aminés, manquait de structure secondaire régulière et n'était pas associée à la membrane, qui s'enroule autour d'une particule virale VIH-1 comme la couverture en cuir d'une balle de baseball. L'extrémité C-terminale de la queue cytoplasmique de gp41, mesurant 105 résidus d'acides aminés, était étroitement associé à la membrane et avait trois hélices alpha avec des parties hydrophobes et des parties hydrophiles. Le groupe UAB a également montré la topologie préférée de la queue cytoplasmique lorsqu'elle est liée à la membrane.
Saad dit que la structure ouvre de nouveaux domaines de recherche :comment la queue cytoplasmique stabilise la structure de la protéine d'enveloppe, comment il affecte la mobilité membranaire de la structure de la protéine d'enveloppe, et comment il aide à coordonner la liaison membranaire et l'association de 2, 000 polyprotéines gag du VIH-1 sous la surface de la membrane. Les polyprotéines Gag sont ensuite coupées à l'intérieur du virus en maturation pour former plusieurs matrices plus petites, protéines de capside et de nucléocapside qui produisent le noyau viral condensé.
Saad dit que la connaissance de la structure de la queue cytoplasmique de la gp41 ouvrira également des études comparatives sur 10 rétrovirus différents qui ont des queues similaires pour savoir pourquoi certaines queues sont plus courtes et d'autres plus longues.
"La queue cytoplasmique de gp41 intéresse depuis longtemps, et personne ne comprend comment il fonctionne dans l'infection ou comment il aide à incorporer la protéine d'enveloppe dans la membrane, ", a déclaré Saad.