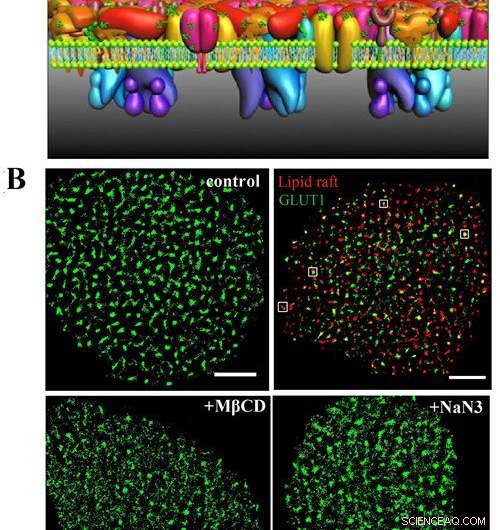
A) C'est le modèle PLLPI de la membrane cellulaire. B) images dSTORM de GLUT1 sur la membrane cellulaire ; GLUT1 et radeaux lipidiques; et distribution de GLUT1 après traitement MβCD et NaN3. Barres d'échelle, 5 µm. Crédit :GAO Jing
Le glucose est la principale source d'énergie et de substrat pour les cellules, et son absorption à travers la membrane plasmique cellulaire dépend largement de la famille du transport du glucose (GLUT). GLUT1, l'un des membres de la famille GLUT, est une protéine membranaire exprimée de manière ubiquitaire. Il est responsable de l'absorption constante de glucose dans de nombreux tissus.
Yan et al. ont rapporté la structure cristalline du GLUT1 humain à une résolution de 3,2 angströms en 2014. Cependant, la distribution détaillée de GLUT1 sur les membranes cellulaires natives n'était pas claire, et comment les organisations protéiques sont liées à leurs fonctions physiologiques sont restées inconnues. Avec la modification et la mise à jour de la structure de la membrane cellulaire, de nombreuses études ont trouvé la distribution hétérogène et en grappes des protéines membranaires.
Un modèle récent de membrane de couche protéique-lipide-protéine (PLLPI) a souligné qu'une couche dense de protéines se formait du côté ectoplasmique de la membrane et des microdomaines protéiques dispersés se formaient du côté cytoplasmique. Pour aborder les caractéristiques de distribution et les mécanismes d'organisation sous-jacents de GLUT1, La microscopie à fluorescence à super-résolution a fourni un outil particulièrement adapté. Il brise la barrière de diffraction et atteint une résolution latérale de l'ordre de quelques dizaines de nanomètres. Il est très approprié pour surveiller directement la taille et la stabilité des agrégations de protéines.
Prof. WANG Hongda de l'Institut de chimie appliquée de Changchun, Académie chinoise des sciences et le professeur XIONG Wenyong de l'Institut de botanique de Kunming, avec les membres de leur équipe, ont d'abord étudié la distribution et l'assemblage de GLUT1 à une résolution nanométrique par microscopie à reconstruction optique stochastique directe (dSTORM).
Ils ont découvert que le transporteur formait des amas d'un diamètre moyen d'environ 250 nm sur les membranes cellulaires HeLa. Il y avait une association spatiale précise entre GLUT1 et les radeaux lipidiques, ce qui a résolu le débat entourant la localisation du transporteur dans les domaines membranaires.
Concernant le mécanisme d'organisation des clusters GLUT1, ils ont révélé que non seulement l'environnement des radeaux lipidiques peut stabiliser leur existence, mais le cytosquelette d'actine et la N-glycosylation jouent également un rôle important dans la formation des clusters.
De plus, ils ont trouvé que l'activation de GLUT1 par l'azoture de sodium ou le MβCD n'augmentait pas son expression membranaire mais induisait la diminution des gros amas.
Les résultats suggèrent une association potentielle entre la distribution et l'activation. Les travaux de leurs équipes pourraient constituer une avancée dans notre compréhension du mécanisme moléculaire du clustering GLUT et de l'absorption du glucose.