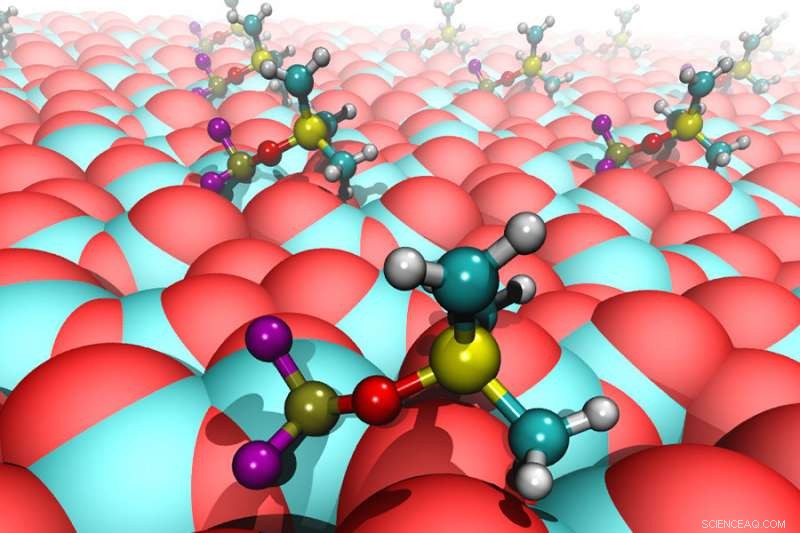
Voici des molécules d'électrolyte marinées (PF
Des chercheurs sur les batteries du laboratoire national d'Argonne du département américain de l'Énergie (DOE) ont découvert une réaction chimique importante qui ressemble à la méthode utilisée pour fabriquer des cornichons. La réaction fournit des informations clés sur le comportement d'un additif électrolytique commun utilisé pour améliorer les performances.
Le système de stockage d'énergie de choix pour les véhicules électriques est la batterie lithium-ion. Dans toutes les batteries de véhicules électriques, plus il y a d'énergie stockée, plus l'autonomie est longue. Actuellement, cependant, la cathode limite la capacité maximale de stockage d'énergie de la batterie lithium-ion. Surmonter cette limitation nécessite des matériaux de cathode qui ont une capacité élevée et fonctionnent à haute tension. Bien que de tels matériaux aient été identifiés, leur utilisation à long terme reste problématique, car ils dégradent l'électrolyte liquide en contact avec la cathode sous tension pendant le cycle de charge-décharge de la cellule lithium-ion.
Un moyen bien connu de résoudre ce problème consiste à insérer un additif améliorant les performances dans l'électrolyte liquide. Cet additif modifie la surface cathodique en formant une couche protectrice qui bloque la décomposition de l'électrolyte. Un tel additif commun, prouvé son efficacité, est le tris(triméthylsilyl)phosphite, mieux connu sous le nom de TMSPi. Le mécanisme derrière son effet bénéfique avait été un mystère – jusqu'à maintenant.
Le nouveau résultat surprenant est que la molécule TMSPi elle-même n'est pas directement impliquée dans la protection de la cathode. Le composant actif est une molécule différente, PF
Ce composé, l'un des nombreux produits de ce type, se forme lentement lorsque le sel de lithium dans l'électrolyte réagit avec le TMSPi. L'un des auteurs argonnais, Scientifique principal des matériaux Daniel Abraham, a comparé le procédé "à la fermentation anaérobie de concombres en saumure, ce qui nous donne de savoureux cornichons."
Dans leurs recherches, Abraham et ses collègues ont démontré que ce "décapage" offre plusieurs effets bénéfiques. Le produit de réaction diminue l'augmentation de la résistance électrique qui se produit normalement dans la cellule de batterie pendant le cycle de charge-décharge. Un ralentissement indésirable des ions lithium se déplaçant entre cathode et anode et un changement irréversible de la composition de la cathode déclenchent l'augmentation de la résistance; la diminution de l'augmentation de la résistance permet une charge et une décharge rapides de la cellule lithium-ion.
Le produit TMPSi réduit également la perte nocive du métal de transition (typiquement du cobalt ou du manganèse) dans le matériau de la cathode. Après s'être échappé de la cathode, les ions de métal de transition traversent l'électrolyte jusqu'à l'anode, dégradant ses performances lors de cycles prolongés. Le produit TMPSi limite non seulement la perte de métal de transition, mais réduit également l'apparition de courants parasites qui dégradent le processus de charge-décharge.
"La clé du succès de cette étude a été l'identification de l'origine de ces effets bénéfiques, " a ajouté Abraham. Il a expliqué que les études informatiques de son équipe ont révélé que le produit de réaction PF
Abraham rapporte également que cette étude de recherche à un stade précoce a une importante application pratique. "Maintenant que l'on comprend mieux le mécanisme de l'action de protection cathodique du phosphite, nous pouvons être plus systématiques pour trouver de nouvelles façons d'obtenir et d'améliorer ce décapage de l'additif électrolytique. »
Un article récemment publié dans The Journal de chimie physique , intitulé "Le décapage chimique des additifs au phosphate atténue l'augmentation de l'impédance dans les batteries Li Ion, " décrit le travail.