La figure montre l'assemblage intra-mitochondrial de Mito-FF. Crédit :UNIST
Assemblage in situ de peptides amphiphiles avec des fonctions cellulaires associées à l'intérieur d'une cellule vivante (c'est-à-dire, assemblage intracellulaire) et leur interaction avec les composants cellulaires sont devenues une stratégie polyvalente pour contrôler le destin cellulaire. Cependant, obtenir un contrôle spatio-temporel (c'est-à-dire, à l'intérieur des organites cellulaires ou d'autres sous-compartiments) sur l'auto-assemblage de molécules synthétiques à l'intérieur de la cellule est difficile en raison de la difficulté d'étudier leurs comportements dans l'environnement intracellulaire complexe.
Une étude récente, affilié à UNIST a développé une nouvelle méthode pour cibler les mitochondries d'une cellule cancéreuse. L'équipe de recherche s'attend à ce que leur étude ouvre la voie à une nouvelle génération de médicaments anticancéreux.
Cette recherche a été dirigée par le professeur Ja-Hyoung Ryu de chimie à l'UNIST en collaboration avec Sang Kyu Kwak de l'énergie et du génie chimique à l'UNIST et le professeur Eunji Lee de la Graduate School of Analytical Science and Technology de l'Université nationale de Chungam. Les résultats de l'étude ont été publiés dans l'édition du 21 avril de Communications naturelles.
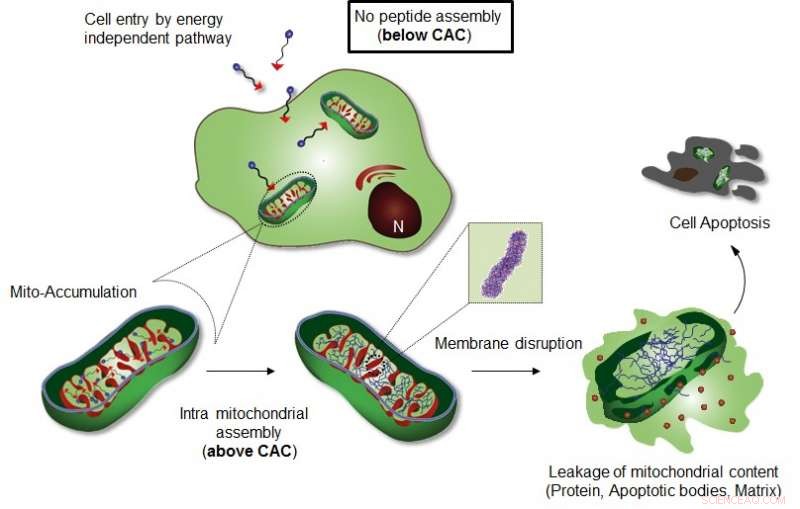
Dans l'étude, l'équipe commune de recherche a introduit, pour la première fois, l'auto-assemblage localisé dans les organites d'un peptide amphiphile en tant que stratégie puissante pour contrôler le destin cellulaire.
L'auto-assemblage est un processus d'équilibre entre les unités de construction individuelles et leur état agrégé, et la concentration des molécules doit être supérieure à la valeur critique pour induire l'assemblage (c'est-à-dire, la concentration critique d'agrégation (CAC). Dans les cellules vivantes, atteindre le CAC est également nécessaire pour former des assemblages de molécules individuelles, mais a une limite car la complexité chimique des environnements cellulaires perturbe les interactions entre les unités de construction synthétiques.
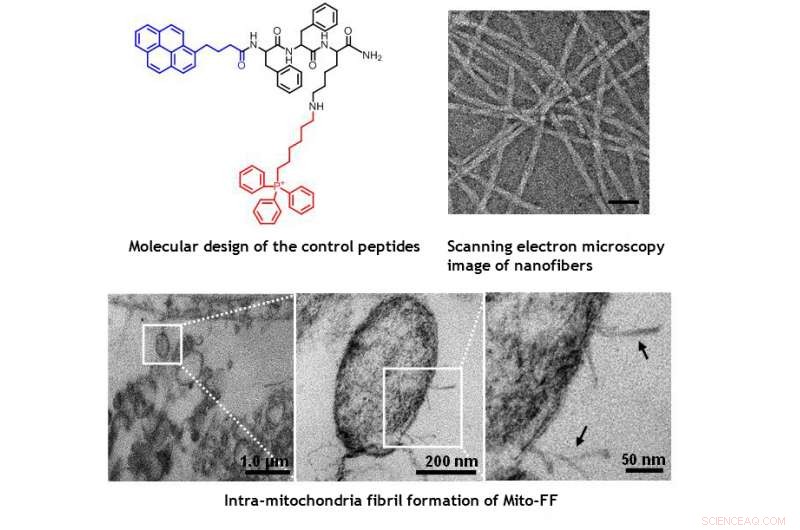
Images MET de mitochondries au sein de la cellule HeLa montrant les dommages morphologiques induits par Mito-FF. Crédit :UNIST
Auto-assemblage intracellulaire, Donc, nécessite une concentration des molécules plus élevée que le CAC, ce qui peut limiter les mises en oeuvre pratiques de molécules auto-assemblantes. Transformation de la structure moléculaire d'unités hydrophiles en unités hydrophobes à l'intérieur de la cellule (ou de l'espace péricellulaire) par des stimuli externes (chimiques, ou physique) est une stratégie puissante pour réduire le CAC en augmentant la propension à l'auto-assemblage. Cependant, stimuli chimiques et physiques (p. léger, Température, pH, et redox) ne sont pas pertinents pour l'assemblage intracellulaire car ils induisent de graves dommages à la cellule.
L'équipe de recherche du professeur Ryu a introduit un système spécifique d'auto-assemblage supramoléculaire induit par la localisation des organites cellulaires (OLISA) qui pourrait être une stratégie générale pour induire l'auto-assemblage en augmentant les concentrations locales des molécules d'auto-assemblage sans traitement supplémentaire. Les petites molécules diffusent facilement à travers la membrane cellulaire, atteindre le site cible (organite ou compartiment subcellulaire selon la fraction de ciblage), puis ils s'auto-assemblent à l'intérieur de l'organite ciblé en raison d'une concentration locale accrue. L'accumulation de molécules à l'intérieur d'un organite comme les mitochondries est d'environ 500-1, 000 fois supérieur à celui de l'espace extracellulaire.
"OLISA est une stratégie plus générale et directe pour réaliser l'assemblage intracellulaire et est entièrement nouveau, c'est une approche prometteuse pour contrôler le destin cellulaire comme l'apoptose, la prolifération cellulaire, etc. et constitue une stratégie utile pour leurs investigations approfondies », explique le professeur Ryu.
La conception consiste en un peptide amphiphile accumulant des mitochondries (Mito-FF), qui se compose de diphénylalanine en tant que bloc de construction formant une feuille β, TPP en tant que fraction de ciblage mitochondrial, et le pyrène comme sonde fluorescente. Mito-FF s'est favorablement accumulé dans les mitochondries des cellules cancéreuses en raison du potentiel membranaire négatif élevé et de la concentration accrue qui ont amené Mito-FF à s'auto-assembler en une structure fibreuse, alors que l'absence de formation de fibrilles a été observée dans les cellules normales. Les fibrilles rigides de Mito-FF ont détruit la membrane mitochondriale et activé la voie apoptotique intrinsèque contre les cellules cancéreuses. Ce système OLISA offre une nouvelle approche pour la chimiothérapie ciblée du cancer.
M.T. Jeena de chimie à UNIST, l'auteur principal de l'étude s'attend à ce que la nouvelle méthode jette les bases d'une nouvelle série de traitements qui pourraient maximiser le processus de guérison tout en minimisant les effets secondaires.