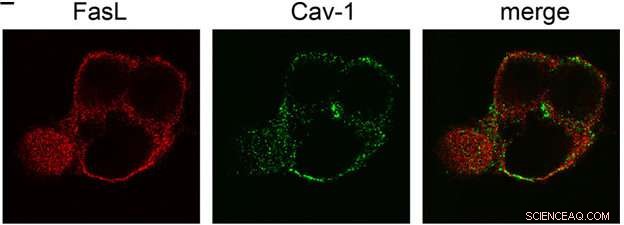
L'emplacement des Fas-ligands (Fas-L) et de la cavéoline (Cav-1) marqués par fluorescence dans la cellule. La dernière image est le chevauchement des canaux Fas-L et Cav-1 (fusion). Obtenu par microscopie confocale à balayage laser. Crédit :Vladimir Gogvadze
Une équipe de scientifiques de MSU et de l'Institut de biophysique théorique et expérimentale de l'Académie des sciences de Russie (situé à Pushchino) ont étudié les mécanismes d'interaction entre la protéine Fas-ligand qui provoque la mort cellulaire et un récepteur membranaire respectif. Pour initier la mort cellulaire, le ligand doit entrer en contact avec un composant protéique spécifique de la cellule, la cavéoline. Si le domaine de liaison à la cavéoline est retiré de la molécule de Fas-ligand, la mort cellulaire peut être évitée. Les résultats de l'étude ont été publiés dans Mort cellulaire et maladie .
Fas-ligand appartient à un groupe de facteurs de nécrose tumorale. Leur tâche principale est d'induire la mort cellulaire, et le processus démarre après interaction avec des "récepteurs de mort" situés à la surface de la membrane plasmique. Le contact initial déclenche une cascade de réactions se terminant par l'apoptose, l'un des modes de mort cellulaire.
"Nous avons étudié les mécanismes de la réaction entre Fas-ligand et son récepteur, et trouvé que pour la stimulation du récepteur, la protéine membranaire cavéoline est nécessaire. Il est rattaché au Fas-ligand, et si nous supprimons le domaine de liaison à la cavéoline, le ligand deviendra considérablement moins toxique pour les cellules. Dans nos expériences, nous avons utilisé des méthodes traditionnelles de biologie cellulaire et moléculaire, " explique le chercheur Vladimir Gogvadze.
Dans une cellule, Fas-ligand est soluble, ou fait partie de la membrane, soit en le traversant, soit en le pénétrant. Dans le dernier cas, un Fas-ligand a extracellulaire, intracellulaire, et les composants membranaires. Le composant extracellulaire est responsable de la reconnaissance des récepteurs, les fonctions du composant membranaire sont mal comprises, et le composant intracellulaire est impliqué dans les processus de transport et de signalisation, ainsi que dans le trafic du ligand dans les radeaux membranaires formés de molécules de cholestérol et de sphingolipides assemblées autour de la cavaeolin. Pour déclencher l'apoptose, le Fas-ligand activé devrait faire partie d'un tel radeau, ce qui indique ses interactions possibles avec les composants de l'environnement membranaire.
En effet, la transcription de la séquence d'acides aminés du ligand Fas a permis d'identifier la présence de domaines spéciaux qui se lient sélectivement à la cavéoline. Les expériences réalisées sur des cellules mutantes ne contenant pas de tels fragments d'amarrage ont confirmé l'hypothèse :Incapable d'interagir avec la cavéoline, la protéine Fas a perdu son activité tueuse, et sa toxicité pour les cellules a diminué. On sait déjà que la cavéoline est capable de supprimer le développement tumoral. Au vu des données obtenues par les chercheurs, on peut supposer qu'un rôle dans ce processus appartient au lien entre la cavéoline et le ligand Fas - ce mécanisme provoque l'apoptose des cellules cancéreuses potentielles.
"La principale valeur de notre travail est de révéler les mécanismes de stimulation de la mort cellulaire. À l'avenir, cela aidera à développer de nouvelles stratégies pour le traitement du cancer, " conclut Vladimir Gogvadze.