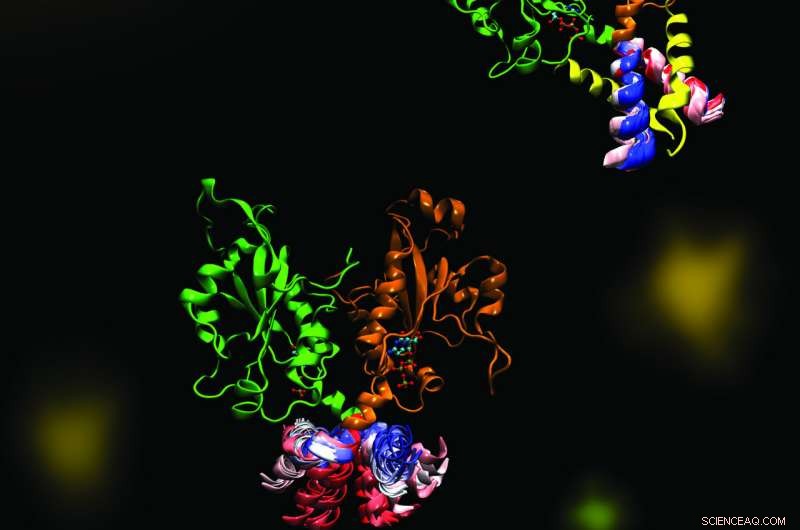
La CCT est une enzyme clé qui maintient une composition équilibrée de phospholipides de la membrane cellulaire. L'image met en évidence la dynamique d'une partie de l'enzyme CCT qui est essentielle à la régulation de ses fonctions. La dynamique moléculaire a été explorée dans le cadre d'une collaboration entre les laboratoires Cornell et Tieleman à l'aide de méthodes informatiques. Crédit :Mohsen Ramezanpour et Jaeyong Lee
La molécule la plus abondante dans les membranes cellulaires est la phosphatidylcholine lipidique (PC, communément appelée lécithine); par conséquent, les enzymes responsables de sa synthèse sont indispensables. Recherche publiée dans le numéro du 4 mai du Journal de chimie biologique ont utilisé des simulations informatiques pour mieux comprendre comment l'une de ces enzymes active et arrête la production de PC. Ces résultats pourraient aider les chercheurs à comprendre pourquoi de petits changements dans cette enzyme peuvent conduire à des conditions telles que la cécité et le nanisme.
Romarin Cornell, professeur de biologie moléculaire et de biochimie à l'Université Simon Fraser au Canada, étudie l'enzyme CTP:phosphocholine cytidylyltransférase, ou CCT. Le CCT définit le taux de production de PC dans les cellules en se liant aux membranes cellulaires à faible teneur en PC. Lorsqu'il est lié aux membranes, l'enzyme CCT change de forme d'une manière qui lui permet d'effectuer l'étape clé limitant la vitesse de la synthèse de PC. Lorsque la quantité de PC constituant la membrane augmente, le CCT tombe de la membrane, et la production de PC cesse.
"La membrane est ce grand réseau macromoléculaire contenant de nombreuses molécules différentes, " Cornell a dit. " Comment cette enzyme reconnaît-elle que 'Oh, Je devrais ralentir parce que la teneur en PC de la membrane devient trop élevée ?'"
Cornell et son équipe de projet - une collaboration avec Peter Tieleman et étudiant diplômé, Mohsen Ramezanpour à l'Université de Calgary et Jaeyong Lee et Svetla Taneva, associés de recherche à SFU - pensaient que la réponse devait être liée aux changements dynamiques de forme que subit l'enzyme lorsqu'elle se lie à une membrane. Mais ces changements sont difficiles à capturer avec les méthodes traditionnelles de biologie structurelle comme la cristallographie aux rayons X, qui prennent un instantané statique des molécules. Au lieu, l'équipe a utilisé des simulations informatiques de la dynamique moléculaire, qui utilisent des informations sur les forces entre chaque atome individuel dans une molécule pour calculer les trajectoires des pièces mobiles de l'enzyme.
"Ce à quoi cela ressemble (quand vous visualisez la sortie), c'est votre grosse molécule qui danse devant vos yeux, " a déclaré Cornell. " Nous n'avons pas configuré la simulation de dynamique moléculaire une seule fois, pas deux fois, mais 40 différents (fois). Il a fallu des mois et des mois pour faire les calculs et encore plus de mois pour essayer d'analyser les données par la suite. En fait, nous avons passé beaucoup de temps une fois que nous avons obtenu les données à simplement regarder sur l'écran ces molécules dansantes. »
La danse simulée de la molécule CCT a montré que lorsque le domaine M, la section de l'enzyme qui se lie typiquement à la membrane, se détache d'une membrane, il accroche le site actif de l'enzyme, l'empêchant d'effectuer sa réaction. Lorsque le segment d'accrochage a été supprimé de la simulation, l'équipe a vu un mouvement de flexion dramatique dans le site d'amarrage pour l'élément d'accrochage, et a émis l'hypothèse que cette courbure créerait un meilleur site actif enzymatique pour catalyser la réaction lorsqu'il est attaché à une membrane. L'équipe a confirmé ces mécanismes à l'aide d'expériences biochimiques en laboratoire.
De façon intéressante, des études génétiques antérieures avaient montré que des mutations dans le gène codant pour le CCT sont responsables d'affections rares comme la dysplasie spondylométaphysaire avec dystrophie cône-tige, qui provoque de graves troubles de la croissance osseuse et de la vision, mais on ne savait pas comment ces changements dans l'enzyme pouvaient conduire à des conséquences aussi dramatiques. Cornell espère que la compréhension du fonctionnement de l'enzyme pourrait aider les chercheurs à le découvrir.
"Si vous n'avez qu'un petit changement dans le CCT, Alors, comment cela va-t-il rendre tout ce processus de synthèse du PC défectueux ?" Demande Cornell. "C'est ce que nous étudions en ce moment."