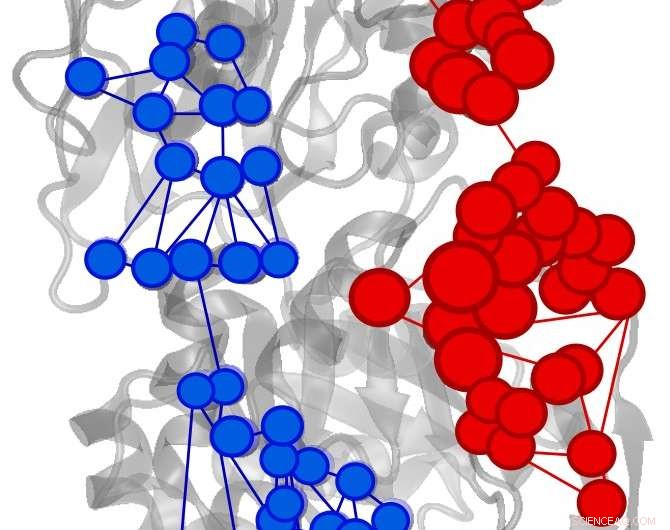
L'effecteur a déclenché une augmentation (rouge) ou une diminution (bleu) du flux d'informations dans l'enzyme IGPS. Crédit :Uriel Morzan
Les scientifiques de Yale ont adopté une nouvelle approche pour démêler la structure complexe et la régulation des enzymes :ils l'ont googlé.
Dans une nouvelle étude publiée en ligne cette semaine dans le Actes de l'Académie nationale des sciences , Le professeur de chimie Victor Batista et ses collègues ont utilisé l'algorithme PageRank de Google pour identifier les acides aminés clés dans la régulation d'une enzyme bactérienne essentielle pour la plupart des micro-organismes.
Les enzymes sont des biomolécules dotées de la capacité unique d'accélérer les réactions chimiques nécessaires à la vie. Bien que ces réactions chimiques se déroulent normalement dans une petite partie de l'enzyme - connue sous le nom de site actif - l'accélération de la réaction est généralement régulée par la liaison d'une molécule dans une partie différente de l'enzyme. La position de liaison est connue sous le nom de site allostérique.
Malgré des décennies d'études, on comprend encore mal comment l'information est transférée du site allostérique au site actif. Une grande partie de la difficulté est liée au grand nombre d'atomes impliqués et à la grande flexibilité structurelle des enzymes.
L'équipe de Yale a noté qu'une question similaire avait été abordée des années plus tôt dans le domaine de l'informatique. Des chercheurs de Google avaient étudié les flux d'informations sur Internet, utiliser le PageRank pour indiquer l'importance de chaque page Web en termes de nombre et de qualité des liens vers d'autres sites Internet.
"Ce problème est tout à fait analogue à l'échange d'informations entre sites distants qui caractérise l'allostérisme, " dit Uriel Morzan, un associé postdoctoral dans le laboratoire de Batista et co-premier auteur de l'étude. "En découvrant comment l'information circule à travers chaque atome change avec la liaison d'un activateur allostérique à l'enzyme, il est possible de trouver les canaux d'information qui sont activés."
Les chercheurs de Yale ont identifié des acides aminés importants pour le processus allostérique dans l'imidazole glycérol phosphate synthase (IGPS), une enzyme bactérienne présente dans la plupart des micro-organismes.
La recherche ouvre la voie à des expériences supplémentaires liées à l'activité IGPS qui peuvent conduire au développement de nouveaux antibiotiques, pesticides, et herbicides.
« C'est passionnant que les méthodes de la science des données commencent à s'infiltrer dans le domaine de la chimie théorique, fournir de nouveaux outils pour comprendre les aspects fondamentaux des systèmes moléculaires catalytiques lorsqu'ils sont combinés à des simulations de dynamique moléculaire de pointe et à la spectroscopie de résonance magnétique nucléaire (RMN), " dit Batista, qui est également membre de l'Institut des sciences de l'énergie sur le campus ouest de Yale.
Co-auteur J. Patrick Loria, un professeur de chimie de Yale et de biophysique et biochimie moléculaires, a ajouté:"C'est la combinaison synergique de la RMN expérimentale et des outils informatiques qui permet cette compréhension plus approfondie de la fonction biologique et démontre l'importance de la collaboration entre les théoriciens et les expérimentateurs."