
Une démonstration de chiralité moléculaire à l'aide de modèles atomiques 3D en laboratoire. Crédit :J. Waser/EPFL
De nombreuses molécules chimiques peuvent exister dans la nature avec leurs homologues miroirs; comme des mains, deux composés peuvent être constitués des mêmes atomes dans la même structure globale mais dans des orientations opposées, c'est-à-dire gaucher et droitier. Ce phénomène de symétrie est appelé « chiralité », et peut donner à ses homologues miroirs ("énantiomères") des propriétés chimiques totalement différentes. Un exemple célèbre et tragique de chiralité est la thalidomide, qui était à l'origine vendu comme un mélange des deux énantiomères. Le problème était que l'un était un sédatif inoffensif et l'autre très toxique pour les fœtus, entraînant des malformations congénitales inquiétantes.
Il est donc devenu impératif aujourd'hui de synthétiser des composés d'une grande "pureté optique", qui est une mesure de la pureté chirale :le degré auquel un échantillon contient un énantiomère en plus grande quantité que l'autre. Mais parce que les énantiomères ont de très petites différences structurelles et une stabilité identique, synthétiser l'un sur l'autre est une tâche très difficile.
Une façon de le faire est ce que les chimistes appellent la "désymétrisation" d'un composé non chiral qui est similaire à la molécule cible. Il s'agit de modifier une molécule pour qu'elle perde les éléments de symétrie qui l'empêchaient d'être chirale.
Des chercheurs du Laboratoire de catalyse et de synthèse organique de Jérôme Waser à l'EPFL ont maintenant développé une nouvelle stratégie de désymétrisation pour accéder à des briques chirales contenant des sous-structures d'urée. Les dérivés d'urée sont des composants importants de biomolécules telles que la biotine (vitamine B7) ou des produits naturels bioactifs, tels que l'anticancéreux agelastatine A.
Les chercheurs ont réalisé deux innovations cruciales. D'abord, ils ont conçu un précurseur de cyclopropane non chiral (cycle de carbone à trois chaînons). Cette molécule offre une réactivité accrue et est idéale pour les réactions dans des conditions douces.
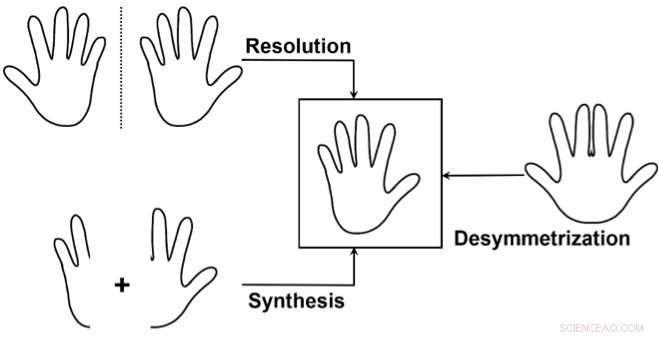
Les trois principales approches pour accéder sélectivement à un énantiomère :1) Séparer un mélange des deux énantiomères (résolution), gaspiller l'un des énantiomères. 2) Synthétiser sélectivement un seul des deux énantiomères. 3) Utiliser une "désymétrisation" d'un composé non chiral similaire à la cible. Ceci est utilisé moins souvent, mais il est particulièrement élégant car il peut révéler la chiralité d'un précurseur déjà relativement complexe en cassant la symétrie en une seule transformation simple. Crédit :J. Waser/EPFL
Seconde, les chercheurs ont conçu un nouveau catalyseur au cuivre qui peut former un énantiomère du produit souhaité avec une sélectivité élevée. Le centre de cuivre se lie et active le précurseur du cyclopropane, provoquant la rupture de ses liens. Le précurseur est alors attaqué par un indole, une molécule très importante en tant qu'élément structurel des composés bioactifs. Par conséquent, le précurseur perd sa symétrie - et devient donc chiral - et peut être utilisé pour fabriquer sélectivement l'énantiomère souhaité.
Le travail est une percée importante, car la désymétrisation n'a jamais été utilisée pour accéder aux urées chirales à partir de cyclopropanes auparavant. « Les nouveaux blocs de construction sont désormais facilement accessibles en tant qu'énantiomères purs, et peut être testé pour la bioactivité ou utilisé pour synthétiser des molécules chirales plus complexes, " précise Jérôme Waser. " Par ailleurs, le nouveau catalyseur que nous avons conçu sera certainement utile pour d'autres applications en chimie de synthèse."
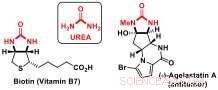
Urées :éléments constitutifs importants des molécules bioactives. Crédit :J. Waser/EPFL