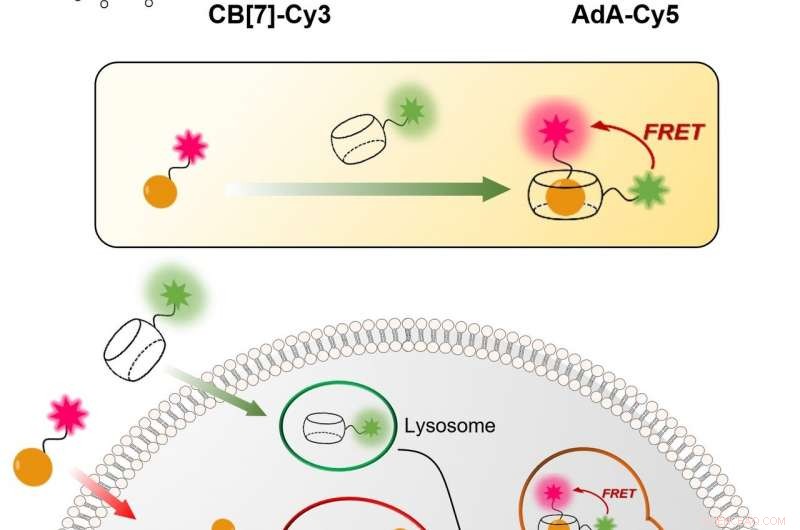
Figure 1 :Technique relativement simple et peu coûteuse pour visualiser le mécanisme de recyclage cellulaire (autophagie) en temps réel. Le processus est basé sur la liaison entre CB[7] et AdA. CB[7] est lié au colorant fluorescent Cy3 (coloré en vert) et pénètre dans les lysosomes, tandis que l'AdA est lié au Cy5 fluorescent (coloré en rouge) qui s'accumule dans les mitochondries. Dans le processus d'autophagie, les deux organites cellulaires fusionnent, conduisant à la rencontre de CB[7] et AdA. Les scientifiques peuvent détecter la fusion, car lorsque les deux colorants fluorescents se rapprochent, ils interagissent les uns avec les autres via le mécanisme de transfert d'énergie de résonance de fluorescence (FRET). De cette façon, l'équipe de recherche peut analyser le processus d'autophagie étape par étape. Crédit : Institut des sciences fondamentales
Une équipe de chercheurs du Centre Auto-assemblage et Complexité, au sein de l'Institut des sciences fondamentales (IBS) ont observé un processus physiologique normal, appelé « auto-manger », que les cellules utilisent pour recycler leurs composants. Ils ont développé une technique précise qui visualise comment les mitochondries, les usines énergétiques des cellules, sont fusionnés avec des lysosomes, machines de recyclage de cellules, afin d'obtenir le matériel détruit et recyclé. Étant donné que des irrégularités dans ce mécanisme peuvent conduire à la maladie d'Alzheimer, Parkinson, et autres complications, cette recherche pourrait contribuer à de futures avancées dans le diagnostic des maladies dégénératives du cerveau et le développement de médicaments. L'étude a été publiée dans Angewandte Chemie Édition Internationale .
Le nom "autophagie" vient de la langue grecque et signifie "se manger soi-même". Aussi étrange que cela puisse paraître, c'est un processus indispensable utilisé pour nettoyer les cellules des organites et des protéines endommagés. Dans les lysosomes, les vieilles parties cellulaires sont décomposées en leurs blocs de construction, qui sont employés pour en construire de nouveaux. Récemment, L'autophagie est devenue un domaine d'étude très actif et a été au centre du prix Nobel de physiologie ou médecine de Yoshinori Ohsumi en 2016.
Un exemple d'organite cellulaire qui doit être périodiquement recyclé est la mitochondrie. La régulation minutieuse de ce processus est essentielle, et des cellules qui ne se divisent pas régulièrement, comme les cellules nerveuses, sont particulièrement vulnérables. Si les cellules accumulent des mitochondries défectueuses, ils peuvent s'abîmer. Cela se produit, par exemple, dans les maladies d'Alzheimer et de Parkinson, où l'accumulation de mitochondries endommagées et de protéines agrégées entraîne la mort neuronale.
On sait que l'autophagie (ou mitophagie, dans le cas particulier des mitochondries) se fait par fusion de deux organites différents, dans ce cas :mitochondries et lysosomes. Cependant, observer le comportement et la fusion des mitochondries et des lysosomes à l'intérieur des cellules a été un défi. À ce jour, la plupart de ces études reposent sur des protéines fluorescentes attachées à un organite, ce qui permet aux scientifiques d'observer un seul organite à la fois. De plus, les protéines fluorescentes elles-mêmes sont dégradées lors de l'autophagie, rendant difficile l'étude précise du mécanisme.
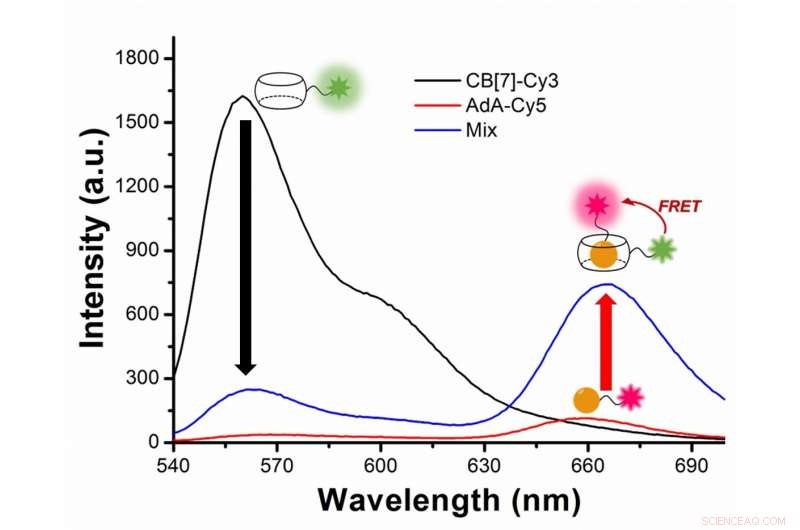
Figure 2 :Étude de l'autophagie avec transfert d'énergie par résonance de fluorescence (FRET) entre le colorant fluorescent verdâtre Cy3 et le colorant fluorescent rouge Cy5. Cy3 émet une fluorescence avec une longueur d'onde maximale à 563 nanomètres (ligne noire), tandis que Cy5 à 670 nanomètres (ligne rouge). Dans l'expérience, Cy3 est attaché à CB[7] et Cy5 à AdA. Au cours de l'autophagie, les deux colorants se rapprochent et Cy3 transfère de l'énergie à son colorant partenaire voisin Cy5, suite au phénomène FRET. Les scientifiques capturent la rencontre des deux colorants sous la forme d'une augmentation de la fluorescence avec une longueur d'onde de 644 à 800 nanomètres (ligne bleue). Crédit : Institut des sciences fondamentales
Les scientifiques de l'IBS de POSTECH ont conçu une procédure quantitative pour visualiser à la fois les mitochondries et les lysosomes au fil du temps. La technique relativement simple et peu coûteuse est plus précise que les techniques actuelles. Il utilise des molécules synthétiques creuses en forme de tonneau, connu sous le nom de cucurbituril (CB[7]), qui se lie avec une force de liaison exceptionnellement élevée à une molécule appelée adamantylamine (AdA) et ne peut pas être dégradée par les lysosomes. CB[7] a été décoré avec un colorant fluorescent (Cy3), tandis que AdA avec un autre colorant (Cy5). Initialement, CB[7]-Cy3 entre dans les lysosomes et Ada-Cy5 dans les mitochondries, puis, lorsque les deux organites fusionnent dans le processus de recyclage, CB[7]-Cy3 et Ada-Cy5 se lient ensemble. De cette façon, l'équipe de recherche a suivi le comportement de différents organites et observé le processus de mitophagie se produisant dans des cellules vivantes. De plus, les expériences ont montré que les deux composés ne sont pas toxiques pour les cellules en dessous d'une dose de 800 nanomolaires.
« La partie la plus difficile de l'expérience a été le choix des produits chimiques. Nous avons choisi des produits chimiques avec la bonne hydrophilie, charger, et la taille moléculaire à incorporer sélectivement dans les mitochondries et les lysosomes, " explique PARK Kyeng Min, l'un des auteurs correspondants de l'étude.
En termes plus techniques, la nouveauté de cet article repose sur l'application du transfert d'énergie par résonance de fluorescence (FRET) à l'étude de l'autophagie. FRET est un transfert d'énergie dépendant de la distance entre deux colorants fluorescents différents; dans ce cas Cy3 et Cy5. Quand les deux sont assez proches, Cy3 donne de l'énergie à Cy5. Les scientifiques capturent la rencontre des deux colorants car le transfert d'énergie de Cy3 à Cy5 conduit à une réduction de l'intensité de fluorescence de Cy3 au profit d'une augmentation de l'intensité d'émission de Cy5.
À l'avenir, une technique similaire pourrait être utilisée pour étudier les processus d'autophagie qui impliquent d'autres organites cellulaires, comme les usines de protéines de l'appareil de Golgi et du réticulum endoplasmique.